
【题目】硝酸铁具有较强的氧化性,易溶于水,乙醇等,微溶于浓硝酸。可用于金属表面化学抛光剂。
(1)制备硝酸铁
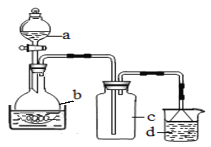
取100mL 8mol· L-1硝酸于a中,取 5.6g铁屑于b中,水浴保持反应温度不超过70℃。
①b中硝酸与铁屑混合后,铁屑溶解,溶液变黄色,液面上方有红棕色气体。写出b中发生反应的离子方程式:_______。
②若用实验制得的硝酸铁溶液,获取硝酸铁晶体,应进行的操作是:将溶液小心加热浓缩、_________、___________,用浓硝酸洗涤、干燥。
(2)探究硝酸铁的性质。用硝酸铁晶体配制0.1mol·L-1硝酸铁溶液,溶液呈黄色,进行实验如下:
实验一:硝酸铁溶液与银反应:
i.测0.1mol·L-1硝酸铁溶液pH约等于1.6 。
ii.将5mL 0.1mol·L-1硝酸铁溶液加到有银镜的试管中,约1min银镜完全溶解。使银镜溶解的反应原理有两个反应:
a. Fe3+使银镜溶解 b. NO3-使银镜溶解
①证明Fe3+使银镜溶解,应辅助进行的实验操作是_________。
②用5mL __________溶液,加到有银镜的试管中,约1.2min银镜完全溶解。证明NO3-使银镜溶解。
③为进一步研究溶解过程,用5mLpH约等于1.6的0.05mol·L-1硫酸铁溶液,加到有银镜的试管中,约10min银镜完全溶解。
实验二:硝酸铁溶液与二氧化硫反应,用如图所示装置进行实验:
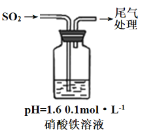
i.缓慢通入SO2,溶液液面上方出现红棕色气体,溶液仍呈黄色。
ii.继续持续通入SO2,溶液逐渐变为深棕色。
已知:Fe2++NO[Fe(NO)]2+(深棕色)
④步骤i反应开始时,以NO3-氧化SO2为主,理由是:_________。
⑤步骤ii后期反应的离子方程式是__________。
(3)由以上探究硝酸铁的性质实验得出的结论是__________。
【答案】Fe + 3NO3- + 6H+=Fe3+ + 3NO2↑ + 3H2O 降温结晶 过滤 取反应后的溶液,加几滴铁氰化钾溶液,有蓝色沉淀 0.1mol·L-1硝酸钠和0.2mol·L-1硝酸的混合溶液或者pH约等于1.6的0.3mol·L-1硝酸钠和硝酸的混合溶液 实验二的步骤i中未观察到溶液变为深棕色,说明没有Fe2+生成 2Fe3+ + SO2 + 2H2O = 2Fe2+ + SO42- + 4H+ 在pH约等于1.6 0.1mol·L-1硝酸铁溶液中, Fe3+、NO3-都有氧化性,其中以NO3-氧化性为主。
【解析】
(1)①硝酸与铁屑混合后,铁屑溶解,溶液变黄色,液面上方有红棕色气体,生成了硝酸铁、二氧化氮和水,据此写离子方程式;
②根据溶液提取晶体的操作回答;
(2) ①如果Fe3+使银镜溶解,则铁的化合价降低变为Fe2+,证明Fe2+的存在即可;
②证明NO3-使银镜溶解,采用控制变量法操作;
④溶液液面上方出现红棕色气体,溶液仍呈黄色;
⑤根据继续持续通入SO2,溶液逐渐变为深棕色,已知:Fe2++NO[Fe(NO)]2+(深棕色),有Fe2+的生成;
(3)总结实验一和实验二可知答案。
(1)①硝酸与铁屑混合后,铁屑溶解,溶液变黄色,液面上方有红棕色气体,生成了硝酸铁、二氧化氮和水,离子方程式为:Fe + 3NO3- + 6H+=Fe3+ + 3NO2↑ + 3H2O,故答案为:Fe + 3NO3- + 6H+=Fe3+ + 3NO2↑ + 3H2O;
②由硝酸铁溶液,获取硝酸铁晶体,应进行的操作是:将溶液小心加热浓缩、降温结晶、过滤、用浓硝酸洗涤、干燥,故答案为:降温结晶;过滤;
(2) ①如果Fe3+使银镜溶解,则铁的化合价降低变为Fe2+,证明Fe2+的存用铁氰化钾溶液,有蓝色沉淀即可,故答案为:取反应后的溶液,加几滴铁氰化钾溶液,有蓝色沉淀;
②证明NO3-使银镜溶解,采用控制变量法操作,即加入的为0.1mol·L-1硝酸钠和0.2mol·L-1硝酸的混合溶液或者pH约等于1.6的0.3mol·L-1硝酸钠和硝酸的混合溶液,故答案为:0.1mol·L-1硝酸钠和0.2mol·L-1硝酸的混合溶液或者pH约等于1.6的0.3mol·L-1硝酸钠和硝酸的混合溶液;
④实验二的步骤i中未观察到溶液变为深棕色,说明没有Fe2+生成,故答案为:实验二的步骤i中未观察到溶液变为深棕色,说明没有Fe2+生成;
⑤根据继续持续通入SO2,溶液逐渐变为深棕色,已知:Fe2++NO[Fe(NO)]2+(深棕色),有Fe2+的生成,离子方程式为:2Fe3+ + SO2 + 2H2O = 2Fe2+ + SO42- + 4H+,故答案为:2Fe3+ + SO2 + 2H2O = 2Fe2+ + SO42- + 4H+;
(3)总结实验一和实验二可知,在pH约等于1.6 0.1mol·L-1硝酸铁溶液中, Fe3+、NO3-都有氧化性,其中以NO3-氧化性为主,故答案为:在pH约等于1.6 0.1mol·L-1硝酸铁溶液中, Fe3+、NO3-都有氧化性,其中以NO3-氧化性为主。


科目:高中化学 来源: 题型:
【题目】已知NA是阿伏加德罗常数的值,下列说法正确的是( )
A.1L0.1molL-1H2C2O4溶液中含C2O![]() 离子数为0.1NA
离子数为0.1NA
B.2molNO与2molO2在密闭容器中充分反应,转移的电子数为8NA
C.32gS8与S6(![]() )的混合物中所含共价键数目为NA
)的混合物中所含共价键数目为NA
D.标准状况下22.4L氯气与甲烷的混合气体,光照时充分反应生成HCl分子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧元素为地壳中含量最高的元素,可形成多种重要的单质和化合物。
(1)氧元素位于元素周期表中___________区;第二周期元素中,第一电离能比氧大的有___________种。
(2)O3可用于消毒。O3的中心原子的杂化形式为___________;其分子的 VSEPR模型为___________,与其互为等电子体的离子为___________(写出一种即可)。
(3)含氧有机物中,氧原子的成键方式不同会导致有机物性质不同。解释C2H5OH的沸点高于CH3OCH3的原因为___________;C2H5OH不能用无水CaCl2千燥是因为Ca2+和C2H5OH可形成[Ca(C2H5OH)4]2+,该离子的结构式可表示为______________________。
(4)氧元素可分别与Fe和Cu形成低价态氧化物FeO和Cu2O。

①FeO立方晶胞结构如图1所示,则Fe2+的配位数为___________;与O2-紧邻的所有Fe2+构成的几何构型为___________。
②Cu2O立方晶胞结构如图2所示,若O2-与Cu+之间最近距离为a pm,则该晶体的密度为___________g·cm-3。(用含a、NA的代数式表示,NA代表阿伏加德罗常数的值)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大危害,必须进行处理.常用的处理方法有两种.方法1:还原沉淀法.
该法的工艺流程为:
其中第①步存在平衡2CrO42(黄色)+2H+Cr2O32(橙色)+H2O
(1)若平衡体系的pH=2,该溶液显______色.
(2)能说明第①步反应达平衡状态的是_____(填序号)
A.Cr2O72和CrO42的浓度相同
B.2v(Cr2O72)=v(CrO42)
C.溶液的颜色不变
(3)第②步中,还原1molCr2O72离子,需要______mol的FeSO47H2O.
(4)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至______.
方法2:电解法.
该法用Fe做电极电解含Cr2O72的酸性废水,随着电解的进行,在阴极附近溶液pH升高,产生
Cr(OH)3沉淀.
(5)用Fe做电极的原因为______(用电极反应式解释).
(6)在阴极附近溶液pH升高,溶液中同时生成的沉淀还有______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于苯的叙述正确的是
A.苯的分子式为C6H6,它不能使酸性KMnO4溶液褪色,属于饱和烃
B.从苯的凯库勒式(![]() )看,苯分子中含有碳碳双键,应属于烯烃
)看,苯分子中含有碳碳双键,应属于烯烃
C.苯的同系物是分子中仅含有一个苯环的所有烃类物质
D.苯分子为平面正六边形结构,6个碳原子之间的价键完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝热反应是铝的一个重要性质,该性质用途十分广泛,不仅被用于焊接钢轨,而且还常被用于冶炼高熔点的金属如钒、铬、锰等。


(1)某校化学兴趣小组同学,取磁性氧化铁按教材中的实验装置(如图甲)进行铝热反应,现象很壮观。指明使用镁条和氯酸钾的目的是 ______________________。
(2)某同学用图乙装置进行铝热反应。取反应后的“铁块”溶于盐酸,向其中滴加KSCN溶液,溶液未见血红色。为测定该实验所得 “铁块”中铁元素含量,设计实验流程如图所示。

几种氢氧化物开始沉淀和完全沉淀的pH如下表所示。
Fe2+ | Fe3+ | Al3+ | Mg2+ | |
开始沉淀时的pH | 7.5 | 2.8 | 4.2 | 9.6 |
沉淀完全时的pH | 9.0 | 4.0 | 5 | 11 |
① 试剂A应选择________,试剂B应选择_______。(填序号)
A.稀盐酸 B.氧化铁 C.H2O2溶液 D.氨水
② 写出反应Ⅱ的离子方程式_____________________。
③ 设计简单实验证明M的成分是Fe2O3而非Fe3O4。
操作 | 预期现象 |
取少量M固体于试管中,向其中加入________________;观察。 | 固体完全溶解,溶液呈黄色。 |
继续向上述溶液中滴入_________________,振荡观察 | ______________________ |
④ 上述实验应灼烧至M质量不变,则能证明M质量不变的标志是____________。
⑤ 若最终红色粉未M的质量为12.0 g,则该“铁块”的纯度是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:常温下,0.01 mol/L MOH溶液的pH为10,MOH(aq)与H2SO4(aq)反应生成1 mol正盐的ΔH=-24.2 kJ·mol-1,强酸与强碱的稀溶液的中和热为ΔH=-57.3 kJ·mol-1。则MOH在水溶液中电离的ΔH为( )
A. -69.4 kJ·mol-1 B. -45.2 kJ·mol-1
C. +69.4 kJ·mol-1 D. +45.2 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.01mol下列物质分别加入l00mL蒸馏水中,恢复至室温,所得溶液中阴离子浓度的大小顺序是(溶液体积变化忽略不计)
①Na2O2 ②Na2O ③Na2SO4 ④NaCl
A.①>②>③>④B.①>②>④>③C.①=②>③>④D.①=②>③=④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在铝与稀硫酸的反应中,已知10s末硫酸的浓度减少了0.6 mol/L,不考虑反应过程中溶液体积的变化,则10s内生成硫酸铝的平均反应速率是( )
A. 0.02 mol/(Lmin)B. 1.2 mol/(Lmin)
C. 1.8mol/(Lmin)D. 0.18 mol/(Lmin)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com