
苯和乙烯相比较,下列叙述正确的是( )
A.都可以与溴水发生取代反应
B.都容易发生加成反应
C.乙烯易发生加成反应,苯不能发生加成反应
D.乙烯易被高锰酸钾酸性溶液氧化,苯不能被高锰酸钾酸性溶液氧化
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
下图是元素周期表的一部分,其中每个数字编号代表对应的一种元素。
| ① | ||||||||
| ② | ③ | ④ | ||||||
| ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
请按要求回答下列问题:
(1)画出元素②的原子结构示意图 。
(2)属于稀有气体的元素编号是_______,可作半导体材料的元素编号是______。
(3)③、⑦两种元素相比较,非金属性强的是 (填元素符号)。
(4)元素④的单质与元素⑤的单质反应可生成两种化合物,化学式分别是 , 。
|
查看答案和解析>>
科目:高中化学 来源: 题型:
门捷列夫在描述元素周期表时,许多元素尚未发现,但他为第四周期的三种元素留下空位,并对它们的一些性质作了预测。X是其中一种“类硅”元素,后来被德国化学家文克勒发现,并证实门捷列夫当时的预测相当准确。根据元素周期律,下列有关X性质的描述中错误的是( )
A、X单质不易与水反应
B、XO2可被碳或氢还原为X
C、XCl4的沸点比SiCl4的高
D、XH4的稳定性比SiH4的高
查看答案和解析>>
科目:高中化学 来源: 题型:
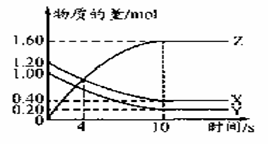
T℃时,在2L的密闭容器中,气体X、Y和Z三种物质的物质的量随时间变化的曲线如下图所示,下列描述正确的是( )
A.容器中化学反应为X(g)+Y(g)=Z(g)
B.0~4 s的平均反应速率小于0~10s时平均反应速率
C使用催化剂只能加快0~10 s间的反应速度
D.0~10s,X表示的平均化学反应速率为0.04mol/(L.S)
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E为前四周期元素,原子序数依次增大。基态A原子的核外电子占据4个原子轨道;B与C同主族,大气平流层中单质B3浓度减少会致人患皮肤癌增加;D是前四周期元素中第一电离能最小的元素;E的合金是当今用量最大的合金。
 (1)E2+ 的核外电子排布式为 。
(1)E2+ 的核外电子排布式为 。
(2)CB32—的立体构型是(用文字描述) ;
其中心原子的杂化轨道类型为 。
(3)根据等电子原理,AB分子的电子式为 ;
其中σ键与π键之比为 。
(4)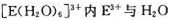 间的作用力为 。
间的作用力为 。
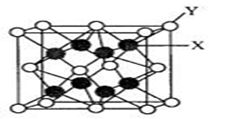
(5)D2C的晶胞结构与CaF2晶胞(如图)相似,则Y应为 (填离子符号);D2C的熔点比CaF2熔点 (填“高”、“低”或“无法比较”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
仅用一种试剂鉴别如下物质:苯、CCl4、NaI溶液、NaCl溶液、Na2SO3溶液,下列试剂中不能选用的是( )
A.溴水 B.FeCl3溶液
C.酸性KMnO4 D.AgNO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室制取硝基苯常用如图装置,请回答下列问题:
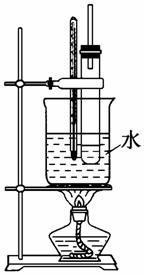
(1)苯的硝化反应是在浓硫酸和浓硝酸的混合酸中进行的,混酸的添加顺序是先加________后加________________。
(2)请写出该反应的方程式_________________________________
__________________________________________________________。
(3)被水浴加热的试管口处都要带一长导管,其作用是________。
(4)苯的化学性质是易取代,那么除了苯的硝化反应外,你还能写出其他的取代反应方程式吗?请写出___________________________
_________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)氢是未来最好的能源选择,制取氢气的成熟的方法有很多,利用甲醇可以与水蒸气反应生成氢气,反应方程式如下:
CH3OH(g) + H2O(g) CO2(g) + 3H2(g)
CO2(g) + 3H2(g)  H(298K)=+ 49.4 kJ/mol
H(298K)=+ 49.4 kJ/mol
一定条件下,向容积为2L的恒容密闭容器中充入1 mol CH3OH(g)和3 mol H2O(g),实验测得:达到平衡状态时,吸收热量19.76 kJ。则
①达平衡时混合气体的压强是反应前的 倍。
②该条件下的该反应的平衡常数是 (结果保留两位有效数字)。
③该条件下反应达平衡状态的依据是(填序号) 。
A.v正(CH3OH)=v正(CO2) B.混合气体的密度不变
C.c(CH3OH)=c(H2O) D.混合气体的总物质的量不变
(2) 甲、乙两容器体积相等,甲容器通入1 mol SO2和1 mol O2,乙容器通入1 mol SO3和0.5 mol O2,发生反应:2SO2(g) + O2 (g)  2SO3(g)
2SO3(g)  H<0,甲、乙起始反应温度相同,均和外界无热量交换,平衡时,甲中SO2的转化率为a,乙中SO3的分解率为b,则a、b的关系为a+b 1(填“﹤”、“﹥”或“=”) 。
H<0,甲、乙起始反应温度相同,均和外界无热量交换,平衡时,甲中SO2的转化率为a,乙中SO3的分解率为b,则a、b的关系为a+b 1(填“﹤”、“﹥”或“=”) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列溶液中,溶质的物质的量浓度为1 mol/L的是( )
A.将40 g NaOH溶于1 L水所得的溶液
B.将80 g SO3溶于水并配成1 L的溶液
C.将0.5 mol/L的NaNO3溶液100 mL加 热蒸发掉50 g水的溶液
热蒸发掉50 g水的溶液
D.含K+为2 mol的K2SO4溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com