
【题目】关于下图所示原电池装置的说法错误的是( )
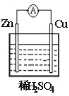
A.Zn为负极,反应为Zn-2e-=Zn2+B.铜棒上发生还原反应
C.电子从锌片经导线流向铜片D.溶液中氢离子浓度保持不变,溶液中SO42-向正极移动
 全程金卷系列答案
全程金卷系列答案科目:高中化学 来源: 题型:
【题目】(1)Cu的价电子排布图______,钾的最高能层符号______。
(2)NH3在水中的溶解度大于H2S在水中的溶解度其原因是______。
(3)用“>、<、=”来比较下列晶体的熔沸点。
CaO______MgO HF______HCl Si______SiC K______Ti
(4)某金属晶体堆积方式为面心立方堆积,其配位数为______;一个该金属晶胞中含有______个该金属原子。
(5)NH3与NH4+的键角大小,NH3______NH4+(用“>、<、=”比较),原因是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2.56 g Cu和一定量的浓硝酸反应,随着Cu的不断减少,反应生成气体的颜色逐渐变浅,当Cu反应完毕时,共收集到气体1.12 L(标准状况),则反应中消耗HNO3的物质的量为 ( )
A.0.13 molB.1 molC.1.05 molD.0.05 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中的实线表示元素周期表的边界。①~⑧分别表示元素周期表中对应位置的元素。

(1)上述元素所能形成的简单离子中半径最小的是________(填离子符号),最高价氧化物对应水化物酸性最强的是________(填分子式)。
(2)写出④与⑥形成的化合物的形成过程____________________
(3)元素①的氢化物电子式为______________。
(4)④、⑤、⑥各自的最高价氧化物对应的水化物两两皆能反应,它们反应的离子方程式为____________,______________,_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
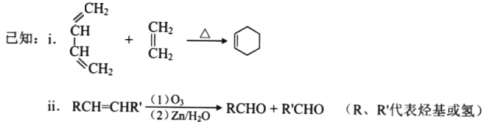
【题目】(17分)顺丁橡胶、制备醇酸树脂的原料M以及杀菌剂N的合成路线如下:
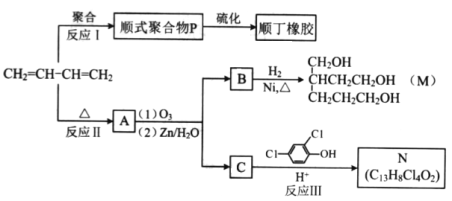
(1)CH2=CH-CH=CH2的名称是_______;
(2)反应I的反应类型是(选填字母)_______;
a.加聚反应 b.缩聚反应
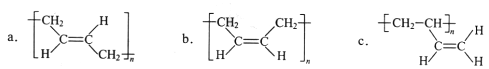
(3)顺式聚合物P的结构式是(选填字母)_______;
(4)A的相对分子质量为108.
①反应II的化学方程式是_____________________
②1molB完全转化为M所消耗的H2的质量是______g。
(5)反应III的化学方程式是______________________________。
(6)A的某些同分异构体在相同反应条件下也能生成B和C,写出其中一种同分异构体的结构简式__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿色化学实验”已走进课堂,下列做法符合“绿色化学”的是

①实验室收集氨气采用图1所示装置
②实验室做氯气与钠的反应实验时采用图2所示装置
③实验室中用玻璃棒分别蘸取浓盐酸和浓氨水做氨气与酸生成铵盐的实验
④实验室中采用图3所示装置进行铜与稀硝酸的反应
A. ②③④B. ①②③C. ①②④D. ①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾可以通过电解法进行制备,装置如图所示,下列说法错误的是

A. 阳极的电极反应式:MnO42- – e-= MnO4-
B. 该装置的离子交换膜为阳离子交换膜
C. 当电路通过a mol电子时,阴极室电解质溶液增加2a mol离子
D. 若电解流出液中KMnO4、K2MnO4和KOH物质的量之比为a∶b∶c,则流进电解池的电解液中K2MnO4和KOH的物质的量之比为 (a + b)∶( c + a )
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学能可与热能、电能等相互转化。下列说法正确的是( )

A.图Ⅰ所示的装置能将化学能转化为电能
B.中和反应中,反应物的总能量比生成物的总能量低
C.化学反应中能量变化的主要原因是化学键的断裂与形成
D.图Ⅱ所示的反应为吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种制备N2H4·H2O(水合肼)和无水Na2SO3的主要实验流程如下:

已知:温度超过40 ℃,Cl2与NaOH溶液反应会生成副产物NaClO3。
⑴“反应Ⅰ”中NaOH应过量且同时减慢通入Cl2的速率,目的是______。
⑵常温时,将Cl2通入NaOH溶液中,一段时间后溶液中将有NaClO3生成,原因是______。
⑶写出“反应Ⅱ”中NaClO与(NH2)2CO反应的化学方程式:______。
⑷“反应Ⅲ”中会有气体______(填化学式)生成,检验有该气体的方法是______。
⑸图所示为Na2SO3的溶解度随温度的变化曲线,由质量分数为10%的Na2SO3溶液制取无水Na2SO3的方法是______。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com