
【题目】在水中加入等物质的量的Ag+、Pb2+、Na+、SO42﹣、NO3﹣、Cl﹣ , 该溶液放在用惰性材料做电极的电解槽中,通电片刻后,则氧化产物与还原产物的质量之比为( )
A.35.5:108
B.16:207
C.8:1
D.108:35.5
 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:
【题目】下列式子属于水解反应,且溶液呈酸性的是 ( )
A.HCO3- + H2O ![]() H3O+ + CO32-
H3O+ + CO32-
B.Fe3+ + 3H2O ![]() Fe(OH)3 + 3H+
Fe(OH)3 + 3H+
C.HS- + H2O ![]() H2S + OH-
H2S + OH-
D.NH4+ + OH- ![]() NH3↑+ H2O
NH3↑+ H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定某烃A的分子组成和结构,对这种烃进行以下实验:
![]() 取一定量的该烃,使其充分燃烧后的气体通过干燥管,干燥管增重
取一定量的该烃,使其充分燃烧后的气体通过干燥管,干燥管增重![]() ;再通过石灰水,石灰水增重
;再通过石灰水,石灰水增重![]() 。
。
![]() 经测定,该烃(气体)
经测定,该烃(气体)![]() 在标准状况下的密度为
在标准状况下的密度为![]() 。
。
现以A为主要原料合成乙酸乙酯,其合成路线如图1所示。
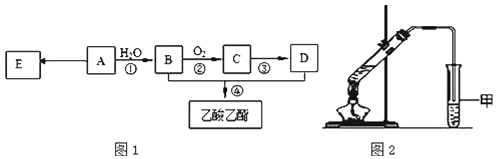
(1)![]() 该烃A能与______g溴发生加成反应;加成产物需______mol溴蒸气完全取代;
该烃A能与______g溴发生加成反应;加成产物需______mol溴蒸气完全取代;
(2)B中官能团的名称是_________,B通过两次氧化可得到D,也可通过加入的氧化试剂为______![]() 任填一种
任填一种![]() 直接氧化为D.
直接氧化为D.
(3)E是常见的高分子材料,写出E的结构简式__________;合成E的反应类型_______________;
(4)某同学用如图2所示的实验装置制取少量乙酸乙酯。实验结束后,试管甲中上层为透明的、不溶于水的油状液体。
①实验开始时,试管甲中的导管不伸入液面下的原因是__________________;
②上述实验中饱和碳酸钠溶液的作用是__________________![]() 填字母
填字母![]() ;
;
A.中和乙酸和乙醇
B.中和乙酸并吸收部分乙醇
C.降低乙酸乙酯在水中的溶解度,有利于分层析出
D.加速酯的生成,提高其产率
![]() 在实验室利用B和D制备乙酸乙酯的实验中,若用1molB和1molD充分反应,不能生成1mol乙酸乙酯,原因是______________________________.
在实验室利用B和D制备乙酸乙酯的实验中,若用1molB和1molD充分反应,不能生成1mol乙酸乙酯,原因是______________________________.
(5)与乙酸乙酯互为同分异构体且能与![]() 反应生成CO2的有机物的结构简式为:
反应生成CO2的有机物的结构简式为:
________________、_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将1.000mol·L-1盐酸滴入20.00mL 1.000mol·L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如下图所示。下列有关说法正确的是( )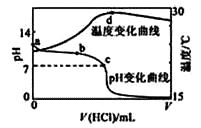
A.a点由水电离出的c(H+)=1.0×10-14mol/L
B.b点:c(NH4+)+c(NH3·H2O) > c(Cl-)
C.c点:反应消耗的HCl 和NH3·H2O 的关系为:n(HCl)= n(NH3·H2O)
D.d点后,溶液温度略下降的主要原因是NH3·H2O电离吸热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在金刚石的晶体中,含有由共价键形成的碳原子环,其中最小的环上所需碳原子数及每个碳原子上任意两个C--C键间的夹角是( )
A.6个120° B.5个108° C.4个109°28′ D.6个109°28′
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.2gH2所占有的体积是22.4L
B.常温下压下32gO2与标准状况下22.4LN2含有相同的分子数
C.标准状况下,22.4LH2O含有6.02×1023个H2O分子
D.11.2LO2的质量是16g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】描述弱电解质电离情况可以用电离度和电离平衡常数表示,下表是常温下几种弱电解质的电离平衡常数:
酸或碱 | 电离常数(Ka或Kb) | 难(微)溶物 | 溶度积常数(Ksp) |
CH3COOH | 1.8×10-5 | BaSO4 | 1×10-10 |
HNO2 | 4.6×10-4 | BaCO3 | 2.6×10-9 |
HCN | 5×10-10 | CaSO4 | 7×10-5 |
HClO | 3×10-8 | CaCO3 | 5×10-9 |
NH3·H2O | 1.8×10-5 |
请回答下面问题:
(1)上述四种酸中,酸性最弱的是 (用化学式表示)。下列能使醋酸溶液中CH3COOH的电离程度增大,而电离常数不变的操作是(填序号)。
A.升高温度 B.加水稀释
C.加少量的CH3COONa固体 D.加少量冰醋酸
(2)CH3COONH4的水溶液呈 (选填“酸性”“中性”或“碱性”),理由是 , 溶液中各离子浓度大小的关系是。
(3)物质的量1∶1的NaCN和HCN的混合溶液,其pH>7,该溶液中离子的浓度从大到小排列为。
(4)工业中常将BaSO4转化为BaCO3后,再将其制成各种可溶性的钡盐(如:BaCl2)。具体做法是用饱和的纯碱溶液浸泡BaSO4粉末,并不断补充纯碱,最后BaSO4转化为BaCO3。现有足量的BaSO4悬浊液,在该悬浊液中加纯碱粉末并不断搅拌,为使SO42-物质的量浓度达到0.01mol·L-1以上,则溶液中CO32-物质的量浓度应 ≥mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:I2+2S2O32-=S4O62-+2I-
相关物质的溶度积常数见下表:
物质 | Cu(OH)2蓝色 | Fe(OH)3红褐 | CuCl白色 | CuI白色 |
Ksp | 2.2×10-20 | 2.6×10-39 | 1.02×10-6 | 1.3×10-12 |
(1)某酸性CuCl2溶液中含有少量的FeCl3 , 为得到纯净的CuCl2·2H2O晶体,加入 , 调至pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=。过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2·2H2O晶体。
(2)在空气中直接加热CuCl2·2H2O晶体得不到纯的无水CuCl2 , 原因是(用化学方程式表示)。由CuCl2·2H2O晶体得到纯的无水CuCl2的合理方法是。
(3)某学习小组用“间接碘量法”测定含有CuCl2·2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.36 g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀。用0.100 0 mol·L-1 Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL。
可选用作滴定指示剂,滴定终点的现象是。
CuCl2溶液与KI反应的离子方程式为。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在反应2SO2+18O22SO3中,其中氧气用18O标记上,其中含有18O的物质有( )
A.SO2
B.O2 、SO3
C.SO2 、 O2 、 SO3
D.SO2 、SO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com