
分析 (1)浓硫酸具有脱水性,能够使有机物脱水;
(2)锌粒放入稀硫酸反应生成硫酸锌和氢气,依据硫元素化合价变化解答;
(3)把铜片放入浓硫酸里并加热,会产生SO2和硫酸铜、水,依据产物及硫元素化合价变化解答;
解答 解:(1)把浓硫酸滴入放在蒸发皿里的蔗糖上,蔗糖就会炭化变黑,体现浓硫酸的脱水性,
故答案为:C;
(2)锌粒放入稀硫酸反应生成硫酸锌和氢气,反应中硫酸中的硫元素化合价不变,体现硫酸的酸性,故答案为:A;
(3)把铜片放入浓硫酸里并加热,会产生SO2和硫酸铜、水,硫元素化合价部分降低,部分不变,硫酸表现强氧化性,酸性;
故答案为:AD.
点评 本题考查了硫酸的性质,明确浓硫酸的强氧化性、脱水性、吸水性是解题关键,题目难度不大,注意脱水性与吸水性的区别.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酶是具有催化功能的蛋白质 | |
| B. | 酶的催化作用具有选择性和专一性 | |
| C. | 高温或紫外线的照射会降低酶的活性 | |
| D. | 酶通常在强酸或强碱的条件下发挥作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4 s(秒)时B的浓度为0.3 mol•L-1 | |
| B. | 4s内用物质A表示的反应速率为0.075 mol•L-1•s-1 | |
| C. | 达平衡后B的转化率为30% | |
| D. | 达平衡后若通入一定量氦气,A的转化率降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将铁粉加入FeCl3、CuCl2混合溶液中,充分反应后剩余的固体中必有铁 | |
| B. | 浓硫酸和浓盐酸长期露置在空气中浓度均降低 | |
| C. | 将CO2气体分别通入BaCl2溶液、Ba(NO3)2溶液中,最终都有沉淀生成 | |
| D. | 用加热分解的方法可将NH4Cl固体和Ca(OH)2固体的混合物分离 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 14 | B. | 15 | C. | 13 | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀硫酸滴在银片上:2Ag+2H+=2Ag++H2↑ | |
| B. | 氧化铁与稀盐酸混合:Fe2O3+6H+=2Fe3++3H2O | |
| C. | 碳酸钙溶于醋酸溶液中:CaCO3+2H+=Ca2++CO2↑+H2O | |
| D. | 澄清石灰水与稀硝酸反应:Ca(OH)2+2H+=Ca2++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
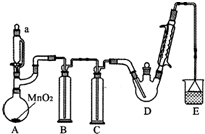 某探究小组设计如图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验.查阅资料,有关信息如下:
某探究小组设计如图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验.查阅资料,有关信息如下:| C2H5OH | CCl3CHO | CCl3COOH | C2H5Cl | |
| 相对分子质量 | 46 | 147.5 | 163.5 | 64.5 |
| 熔点/℃ | -114.1 | -57.5 | 58 | -138.7 |
| 沸点/℃ | 78.3 | 97.8 | 198 | 12.3 |
| 溶解性 | 与水互溶 | 可溶于水、乙醇 | 可溶于水、乙醇、三氯乙醛 | 微溶于水,可溶于乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com