
【题目】氧化钪(Sc2O3)是一种稀土氧化物,可用于制作激光、半导体材料。以钪锰矿石(主要含MnO2、SiO2及少量Sc2O3、Al2O3、CaO、FeO)为原料制备Sc2O3的工艺流程如图,其中TBP和P507均为有机萃取剂。
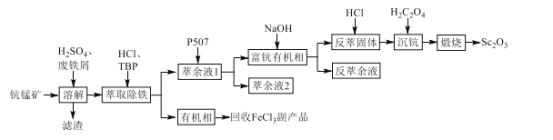
回答下列问题:
(1)Sc2O3中Sc的化合价为___。
(2)“溶解”时铁屑被MnO2氧化为Fe3+,该反应的离子方程式是___。
(3)“滤渣”的主要成分是___。
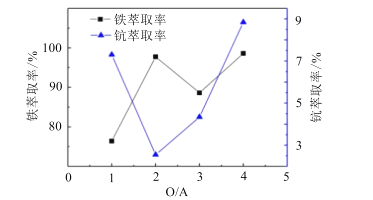
(4)“萃取除铁”时铁和钪的萃取率与O/A比(有机相与水相的体积比)的关系如图所示。该工艺中最佳O/A比为___。
(5)有机萃取剂P507萃取Sc3+的反应原理为阳离子交换:ScCl3+3HR=ScR3+3HCl(HR代表P507)。在“富钪有机相”中反应生成Sc(OH)3的化学方程式是___。
(6)“萃余液2”中的金属阳离子除Al3+、Ca2+外,还有___。
(7)Sc2(C2O4)3在空气中“煅烧”生成Sc2O3的化学方程式是___。
(8)某厂用1000kg的钪锰矿制备Sc2O3,最终得到Sc2O3306g,该矿中含钪的质量分数为___。
【答案】+3 3MnO2+2Fe+12H+=3Mn2++2Fe3++6H2O SiO2 2 ScR3+3NaOH=3NaR+Sc(OH)3↓ Mn2+ 2Sc2(C2O4)3+3O2![]() 2Sc2O3+12CO2 0.02%
2Sc2O3+12CO2 0.02%
【解析】
钪锰矿石(主要含MnO2、SiO2及少量Sc2O3、Al2O3、CaO、FeO),加入稀硫酸后,溶液中含有Al3+,Fe2+,Ca2+,Sc3+,再加入Fe,可以将二氧化锰还原为Mn2+,铁被氧化成Fe3+,滤渣中含有SiO2,TBP和HCl加入除去Fe3+,得到有机相和萃余液1,萃余液1加入有机萃取剂P507萃取Sc3+,萃余液2中剩余Al3+、Ca2+、Mn2+,富钪有机相加入氢氧化钠后得到反萃固体Sc(OH)3,加入HCl得到ScCl3,加入H2C2O4后得到Sc2(C2O4)3,在空气中煅烧后Sc2O3,据此分析。
(1)Sc2O3中O的化合价为-2价,根据元素的化合价之和等于0,则Sc的化合价为+3价;
(2)“溶解”时铁屑被MnO2氧化为Fe3+,MnO2还原Mn2+,溶液为酸性,有氢离子参与反应,根据元素守恒补齐生成物水,反应的离子方程式:3MnO2+2Fe+12H+=3Mn2++2Fe3++6H2O;
(3)钪锰矿石中不与硫酸和废铁屑反应的物质为二氧化硅,“滤渣”的主要成分是SiO2;
(4)从图中可以看出,萃取除铁时需要将铁的萃取率最高,钪的萃取率最低,此时该工艺中最佳O/A比为2;
(5)在“富钪有机相”中反应生成Sc(OH)3,ScR3与氢氧化钠反应生成Sc(OH)3,化学方程式是ScR3+3NaOH=3NaR+Sc(OH)3↓;
(6)除去铁离子后,“萃余液1”中含有Sc3+,“萃余液2”中的金属阳离子除Al3+、Ca2+外,还有Mn2+;
(7)Sc2(C2O4)3在空气中“煅烧”生成Sc2O3和二氧化碳的化学方程式是2Sc2(C2O4)3+3O2![]() 2Sc2O3+12CO2;
2Sc2O3+12CO2;
(8)某厂用1000kg的钪锰矿制备Sc2O3,最终得到Sc2O3306g,钪元素的质量等于三氧化二钪的质量×钪元素的质量分数![]() ,
,
该矿中含钪的质量分数为![]() 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】一种类似钻石的装饰品——锆石(ZrSiO4),其做为装饰品,价格低廉,外观璀璨。天然锆石中常含有Fe、Al、Cu的氧化物杂质,称为锆英石。工业上一种以锆英石为原料制备ZrO2的工艺流程如下:

Ⅰ. Zr在化合物中通常显![]() 价,氯化过程中除C、O元素外,其它元素均转化为其高价氯化物;
价,氯化过程中除C、O元素外,其它元素均转化为其高价氯化物;
Ⅱ.SiCl4极易水解生成硅酸;ZrCl4易溶于水,400℃升华
Ⅲ.Fe(SCN)3难溶于MIBK,Zr (SCN) 4在水中的溶解度小于在MIBK中的溶解度。
请回答下列问题
(1)滤渣1的主要成分是:______________
(2)①“氯化”过程中,锆石(ZrSiO4)发生反应的化学方程式为______________
②ZrCl4产率随温度、压强的变化如图所示,回答问题
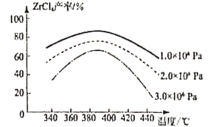
“氯化”过程选择的最佳条件为_______;“氯化”环节产率随温度升高先增大后减小的原因为______
(3)“滤液1”中含有的阴离子,除OH-外还有____________________
(4)①常用的铜抑制剂为NaCN (氰化钠),NaCN可与重金属阳离子反应,生成溶度积较小的沉淀(如Cu(CN)2,Ksp=4×10-10),已知盐酸溶解后的溶液中Cu2+的浓度为1mol/L,若需要溶液中Cu2+浓度等于1.0×10-6 mol/L,则预处理1L该溶液需要1mol/LNaCN溶液的体积为_____________(假设溶液混合后体积可以相加,计算结果保留两位小数)
②由于氰化钠有剧毒,因此需要对“废液”中的氰化钠进行处理,通常选用漂白粉或漂白液在碱性条件下将其氧化,其中一种产物为空气的主要成分,则在碱性条件下漂白液与氰化钠反应的离子方程式为_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,有错误的是( )
A.Na2CO3溶液能与石灰水反应,而NaHCO3溶液不能与石灰水反应
B.在相同温度下,NaHCO3的溶解度比Na2CO3小
C.Na2CO3很稳定,而NaHCO3受热时容易分解
D.将等物质的量的NaHCO3粉末与Na2CO3粉末同时分别倒入适量的相同浓度的稀盐酸中,前者的反应更剧烈
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从甜橙的芳香油中可分离得到如图结构的化合物,
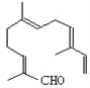
现有试剂:①KMnO4酸性溶液;②H2/Ni;③Ag(NH3)2OH;④新制Cu(OH)2,能与该化合物中所有官能团都发生反应的试剂有( )
A.①②B.②③C.③④D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纪录片《我在故宫修文物》表现了文物修复者穿越古今与百年之前的人进行对话的职业体验,让我们领略到历史与文化的传承。下列文物修复和保护的过程中涉及化学变化的是( )
A | B | C | D |
|
|
|
|
银器用除锈剂除锈 | 变形的金属香炉复原 | 古画水洗除尘 | 木器表面擦拭烫蜡 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学探究金属Na与CO2的反应,实验如下:
实验I | 实验II | |
操作 | 将点燃的金属钠伸到盛有CO2的集气瓶中 | 将实验I的集气瓶用水冲洗,过滤。取黑色滤渣灼烧;取滤液分别滴加酚酞和氯化钡溶液 |
现象 | ①火焰呈黄色 ②底部有黑色固体,瓶壁上附有白色固体 | ①黑色滤渣可燃 ②滤液能使酚酞溶液变红,滴加氯化钡溶液有白色沉淀生成 |
下列说法不正确的是
A. 生成的黑色固体中含有CB. 白色固体是Na2O
C. 实验说明CO2具有氧化性D. 金属Na着火不能用CO2灭火
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜碘杂化团簇具有优异的光学性能,可用于制备发光二极管、发光墨水、生物成像仪器等。一种铜碘杂化团簇的合成路线如图:
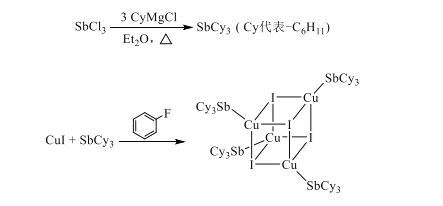
(1)已知SbCl3(三氯化锑)是挥发性显著的物质,由此判断SbCl3中主要含有的化学键类型是___。
(2)Sb为第四周期VA族元素,预测SbCl3的立体结构为___。
(3)Et2O(CH3CH2OCH2CH3,乙醚)中氧原子以及![]() 中碳原子的杂化类型分别是___、___。
中碳原子的杂化类型分别是___、___。
(4)CuI中Cu+的核外电子排布式为___。
(5)SbCy3只能与一个Cu+配位的原因是___。
(6)已知上述铜碘杂化团簇属四方晶系,晶胞参数分别为anm、bnm、cnm,棱间夹角为α=β=γ=90°,平均一个晶胞含有一个铜碘杂化团簇,该团簇的化学式为___。设阿伏加德罗常数的值为NA,已知SbCy的相对分子量是371,则该铜碘杂化团簇的密度是___g·cm-3(列计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】青蒿素是从黄花蒿中提取的一种无色针状晶体,其结构如图1,请回答下列问题:
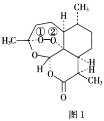
(1)基态O原子的价电子排布图为___。
(2)组成青蒿素的三种元素中电负性最大的是__(填元素符号,下同),第一电离能最大的是__。
(3)基态N原子的未成对电子数为___。
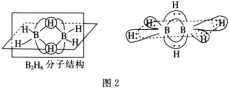
(4)双氢青蒿素是青蒿素的重要衍生物,其抗疟疾疗效优于青蒿素,双氢青蒿素的合成一般是在相转移催化剂聚乙二醇的作用下,用硼氢化钠(NaBH4)还原青蒿素。两种硼氢化物的合成原理如下:
2LiH+B2H6=2LiBH4;4NaH+BF3=NaBH4+3NaF
BH4-的空间构型为__;B2H6分子的结构如图2,B2H6中B的杂化方式为__。
聚乙二醇[HO(CH2CH2O)nH]随着n值的增大,水溶性降低,原因是___。
(5)NaH的晶胞与NaCl相同,NaH晶体中阳离子的配位数是__;设晶胞中阴、阳离子为刚性球体且恰好相切,阴、阳离子的半径比约为__(已知![]() ≈1.414,结果保留三位有效数字)。
≈1.414,结果保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘化钠在光学器件石油探测、安检、环境监测等领域有重要应用。某研究小组开发设计的制备高纯NaI的简化流程如图:

已知:
①I2(s)+I-(aq)![]() I3-(aq)。
I3-(aq)。
②水合肼(N2H4H2O)具有强还原性,可分别将碘的各种酸根和I2还原为I-,本身被氧化为无毒物质。
③NaI易溶于水,也易溶于酒精,在酒精中的溶解度随温度的升高增加不大。
请回答:
(1)步骤Ⅰ,I2与NaHCO3溶液发生歧化反应,生成物中含IO-和IO3-离子。
①I2与NaHCO3溶液反应适宜温度为40~70℃,则采用的加热方式为___。
②实验过程中,加少量NaI固体能使反应速率加快,其原因是___。
(2)步骤Ⅱ,水合肼与IO反应的离子方程式为___。
(3)步骤Ⅲ,多步操作为:
①将步骤Ⅱ得到的pH为6.5~7的溶液调整pH值至9~10,在100℃下保温8h,得到溶液A;
②将溶液A的pH值调整至3~4,在70~80℃下保温4h,得溶液B;
③将溶液B的pH调整至6.5~7,得溶液C;
④在溶液C中加入活性炭,混合均匀后煮沸,静置10~24h后,过滤除杂得粗NaI溶液。上述①②③操作中,调整pH值时依次加入的试剂为___。
A.NaOH B.HI C.NH3H2O D.高纯水
(4)步骤Ⅳ,采用改进的方案为用“减压蒸发”代替“常压蒸发”。
①“减压蒸发”需选用的仪器除了圆底烧瓶、蒸馏头、温度计、接收管、接收瓶之外,还有___。
A.直形冷凝管 B.球形冷凝管 C.烧杯 D.抽气泵
②采用“减压蒸发”的优点为___。
(5)将制备的NaI2H2O粗品以无水乙醇为溶剂进行重结晶。请给出合理的操作排序___。
加热乙醇→ → → → →纯品(选填序号)。
①高纯水洗涤 ②减压蒸发结晶 ③NaI2H2O粗品溶解 ④趁热过滤 ⑤真空干燥 ⑥抽滤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com