
| A. | $\frac{{r}_{(p)}}{{r}_{(Si)}}$ | B. | $\frac{{r}_{(Be)}}{{r}_{(Mg)}}$ | C. | $\frac{{r}_{({K}^{+})}}{{r}_{(N{a}^{+})}}$ | D. | $\frac{{r}_{(cl)}}{{r}_{(c{l}^{-})}}$ |
分析 A.同周期元素的原子半径从左向右在减小;
B.同主族自上而下原子半径增大;
C.电子层越多离子半径越大;
D.同种元素的阴离子半径大于其原子半径.
解答 解:A.Si、P同周期,原子半径从左向右逐渐减小,故$\frac{{r}_{(p)}}{{r}_{(Si)}}$<1,故A错误;
B.Be、Mg同主族,自上而下原子半径增大,故原子半径Mg>Be,则$\frac{{r}_{(Be)}}{{r}_{(Mg)}}$<1,故B错误;
C.K+比Na+多一个电子层,则离子半径K+>Na+,故$\frac{{r}_{({K}^{+})}}{{r}_{(N{a}^{+})}}$>1,故C正确;
D.同种元素的阴离子半径大于其原子半径,则$\frac{{r}_{(cl)}}{{r}_{(c{l}^{-})}}$<1,故D错误,
故选C.
点评 本题考查微粒半径的比较,明确原子半径比较、离子半径与原子半径的关系即可解答,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
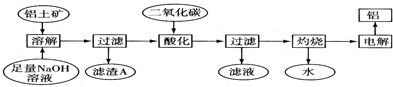
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
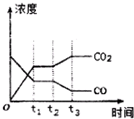 节能减排是当下环境保护的重点.
节能减排是当下环境保护的重点.| H2O | CO | CO2 | H2 | |
| n/mol | 0.20 | 0.20 | 0 | 0 |
| 容器编号 | c(CO)/mol•L-1 | c(O2))/mol•L-1 | c(CO2))/mol•L-1 | v(正)和v(逆)比较 |
| Ⅰ | 2.0×10-4 | 4.0×10-4 | 4.0×10-2 | v(正)=v(逆) |
| Ⅱ | 3.0×10-4 | 4.0×10-4 | 5.0×10-2 | v(正)>v(逆) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③④⑤ | B. | ④⑤⑦ | C. | ④⑤ | D. | ③④⑤⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 操作 | 现象 | 结论 |
| 取少量除尽Ag+后的溶液于试管中,加入KSCN溶液,振荡 | 溶液变(血)红色 | 存在Fe3+ |
| 取少量除尽Ag+后的溶液于试管中,加入1~2滴③或④(填序号)溶液,振荡 | 紫红色褪去或产生蓝色沉淀 | 存在Fe2+ |
| 实验编号 | 操 作 | 现 象 |
| a | 加入足量氨水,振荡 | 黑色固体不溶解 |
| b | 加入足量稀硝酸,振荡 | 黑色固体溶解,并有气体产生 |
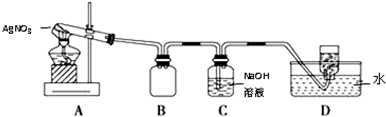
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
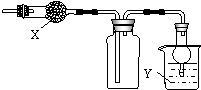 如图是用于干燥、收集并吸收多余气体的装置,下列方案正确的是( )
如图是用于干燥、收集并吸收多余气体的装置,下列方案正确的是( )| 选项 | X | 收集气体 | Y |
| A | 碱石灰 | 氯化氢 | 水 |
| B | 碱石灰 | 氨气 | 水 |
| C | 氯化钙 | 二氧化硫 | 氢氧化钠溶液 |
| D | 氯化钙 | 一氧化氮 | 氢氧化钠溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com