
分析 (1)A样品与盐酸反应,Na2S、Na2SO3、Na2S2O3会反应生成NaCl,由蒸干滤液后一定含有NaCl,最后得到8.19g纯净物B,则说明原样品A中没有Na2SO4,B是NaCl;
(2)100 mL 2.2 mol/L的盐酸反应后最终得到100mLpH=0的溶液,则HCl有剩余,则消耗HCl为0.1L×2.2mol/L-0.1L×1.0mol/L=0.12mol,可知生成的NaCl为0.12mol,故生成NaCl的质量=0.12mol×58.5g.mol=7.02 g<8.19g,可知样品A中必定有NaCl;
(3)反应生成的气体不能使品红溶液褪色,则为H2S,根据Na2S+2HCl=2NaCl+H2S↑计算该反应生成消耗HCl物质的量、Na2S的物质的量;
由于样品A由三种混合而成,则A组成情况可能为:①A为Na2S、Na2SO3和NaCl混合,②A为Na2S、Na2S2O3和NaCl混合,计算Na2S、Na2SO3(或Na2S2O3)共同与盐酸反应时应消耗HCl的物质的量,由2Na2S+Na2SO3+6HCl=6NaCl+3S↓+3H2O,2Na2S+Na2S2O3+6HCl=6NaCl+4S↓+3H2O,可知Na2S~3HCl,进而计算该反应中Na2S的物质的量;
(4)由钠离子守恒,则Na2S、Na2SO3(或Na2S2O3)的总物质的量为$\frac{0.12mol}{2}$=0.06mol,恰好发生反应:2Na2S+Na2S2O3+6HCl=6NaCl+4S↓+3H2O,化合物中S元素全部转化为S单质时得到沉淀量最大.
解答 解:(1)A样品与盐酸反应,Na2S、Na2SO3、Na2S2O3会反应生成NaCl,由蒸干滤液后一定含有NaCl,最后得到8.19g纯净物B,则说明原样品A中没有Na2SO4,B是NaCl,
故答案为:NaCl;
(2)100 mL 2.2 mol/L的盐酸反应后最终得到100mLpH=0的溶液,则HCl有剩余,则消耗HCl为0.1L×2.2mol/L-0.1L×1.0mol/L=0.12mol,可知生成的NaCl为0.12mol,故生成NaCl的质量=0.12mol×58.5g.mol=7.02 g<8.19g,可知样品A中必定有NaCl,
答:A中含有NaCl;
(3)反应生成的气体不能使品红溶液褪色,则为H2S,
Na2S+2HCl=2NaCl+H2S↑
1 mol 2 mol 22.4 L
n′(Na2S) n(HCl) VL
则n′(Na2S)=$\frac{VL×1mol}{22.4L}$=$\frac{V}{22.4}$mol
n(HCl)=$\frac{VL×2mol}{22.4L}$=$\frac{V}{11.2}$mol
而整个过程实际参加反应的HCl为0.12 mol,
由于样品A由三种混合而成,则A组成情况可能为:①A为Na2S、Na2SO3和NaCl混合,②A为Na2S、Na2S2O3和NaCl混合,
由2Na2S+Na2SO3+6HCl=6NaCl+3S↓+3H2O,2Na2S+Na2S2O3+6HCl=6NaCl+4S↓+3H2O,可知Na2S~3HCl,故n″(Na2S)=$\frac{1}{3}$(0.12-$\frac{V}{11.2}$)mol,
则n(Na2S)=n′(Na2S)+n″(Na2S)=$\frac{V}{22.4}$mol+$\frac{1}{3}$(0.12-$\frac{V}{11.2}$)mol=(0.04-$\frac{V}{15.8}$)mol,
故答案为:(0.04-$\frac{V}{15.8}$);
(4)由钠离子守恒,则Na2S、Na2SO3(或Na2S2O3)的总物质的量为$\frac{0.12mol}{2}$=0.06mol,恰好发生反应:2Na2S+Na2S2O3+6HCl=6NaCl+4S↓+3H2O,化合物中S元素全部转化为S单质时得到沉淀量最大,此时Na2S、Na2S2O3的物质的之比为2:1,物质的量分别为0.04mol、0.02mol,则生成S为0.08mol,生成S的最大质量为0.08×32g/mol=2.56g,
故答案为:2.56g.
点评 本题考查混合物的计算,关键是明确发生的反应,侧重考查学生的分析计算能力,(3)(4)为易错点、难点,注意计算混合物的总物质的量,题目难度较大.


科目:高中化学 来源: 题型:实验题
| 紫铜 | 青铜 | 铜绿 | |
| 主要成分 | 纯铜 | 铜锡合金 | Cu2(OH)2CO3 |
| 性质与用途 | 紫红色,质软,导电性能良好;主要用作电线电缆. | 多呈灰绿色,熔点低、硬度大、可塑性强;可铸造成各种器具. | 不溶于水的灰绿色粉末,溶于酸,加热易分解;可作颜料、杀虫剂. |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | B与A只能组成BA3化合物 | |
| B. | C、D、E形成的化合物与稀硫酸可能发生氧化还原反应 | |
| C. | A、B、C形成的化合物一定不能发生水解 | |
| D. | E的氧化物对应的水化物一定有强的氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
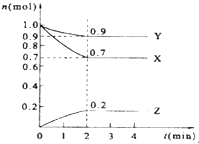 某温度时,在2L的密闭容器中,X、Y、Z三种气体物质的量随时间的变化曲线如图所示.
某温度时,在2L的密闭容器中,X、Y、Z三种气体物质的量随时间的变化曲线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 操作 | 现象 | 结论 | |
| A | 向试管中的无色溶液内滴加稀NaOH溶液,将湿润的红色石蕊试纸置于试管口 | 试纸不变蓝 | 不能确定原溶液中是否含有NH4+ |
| B | 加热盛有铜与浓硫酸的试管,发现试管底部出现白色固体,直接向试管中加入适量水 | 白色固体溶解,溶液变蓝色 | 白色固体为无水硫酸铜 |
| C | 将稀硫酸酸化的H2O2溶液滴入FeCl2溶液中 | 溶液变黄色 | 氧化性:H2O2>Fe3+ |
| D | 向蔗糖中加入浓硫酸,并不断用玻璃棒搅拌 | 变黑,体积膨胀,放出刺激性气体 | 浓硫酸具有脱水性和强氧化性,反应中生成C、SO2和CO2等 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
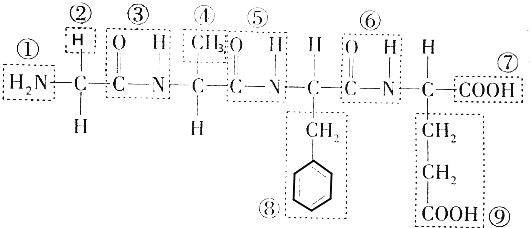
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能发生脂化反应的酸一定是羧酸 | |
| B. | 蛋白质溶液中加入浓Na2SO4溶液,蛋白质从溶液中凝聚而析出叫盐析 | |
| C. | 天然蛋白质一定条件下水解的最终产物是α-氨基酸 | |
| D. | 淀粉、纤维素和油脂在一定条件下都能发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| Y | ||||
| Q | W | X | Z |
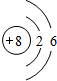 ;举一例说明Z的非金属性比X的非金属性强的事实:酸性强弱;HClO4>H3PO4,或稳定性:HCl>PH3.
;举一例说明Z的非金属性比X的非金属性强的事实:酸性强弱;HClO4>H3PO4,或稳定性:HCl>PH3.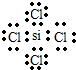 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com