
| A. | MgCl2晶体中的化学键是离子键 | |
| B. | 某物质在熔融态能导电,则该物质中一定含有离子键 | |
| C. | H2和Cl2两种分子中,每个原子的最外层都具有8电子稳定结构 | |
| D. | 干冰是分子晶体,其溶于水生成碳酸的过程只需克服分子间作用力 |
分析 A、MgCl2晶体中的化学键是离子键;
B、金属在熔融态能导电;
C、H2分子中是氢氢键,而Cl2分子中氯氯单键,氢最外层达2个电子的稳定结构;
D、干冰是分子晶体,其溶于水生成碳酸的过程中伴有化学键的断裂与形成.
解答 解:A、MgCl2晶体中的化学键是离子键,故A正确;
B、金属在熔融态能导电,不含离子键,故B错误;
C、H2分子中是氢氢键,而Cl2分子中氯氯单键,氢最外层达2个电子的稳定结构,故C错误;
D、干冰是分子晶体,其溶于水生成碳酸的过程中伴有化学键的断裂与形成,所以不仅是克服分子间作用力,故D错误;
故选A.
点评 本题考查化学键的类型、物质的导电性、8电子稳定结构等,难度不大,注意化学反应的实质是化学的断裂与形成的过程.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室制取乙烯时,放入几片碎瓷片,以避免混合液在受热沸腾时剧烈跳动 | |
| B. | 将铜丝弯成螺旋状,在酒精灯上加热变黑后,立即伸入盛有无水乙醇的试管中,完成乙醇氧化为乙醛的实验 | |
| C. | 乙醇中含有少量水不能用金属钠除去 | |
| D. | 试管中先加入一定量浓硫酸,再依次加入适量冰醋酸、无水乙醇,然后加热制取乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解过程中阴极质量不断减少 | |
| B. | 电解过程中溶液的pH不断升高 | |
| C. | 此时向溶液中加入适量的Ag2O固体可使溶液恢复电解前的状况 | |
| D. | 电解后两极产生的气体体积比为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
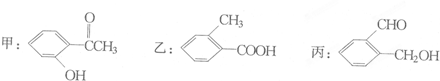
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
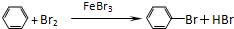 属于取代反应
属于取代反应 属于取代反应
属于取代反应 属于加聚 反应
属于加聚 反应查看答案和解析>>
科目:高中化学 来源: 题型:选择题
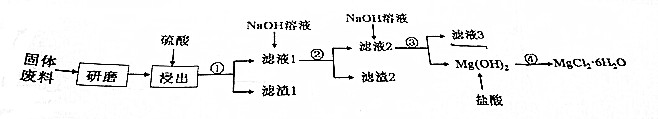
| A. | “浸出”步聚中,可适当提高反应温度、增加浸出时间提高镁的浸出率 | |
| B. | 滤渣1的主要成分是CaSO4,滤液3的主要成分是Na2SO4 | |
| C. | 第1次加Na0H溶液需控制PH的目的是除去Cu2+和Al3+ | |
| D. | ①②③的操作步骤都是过滤,④的操作步骤是蒸发浓缩、冷却结晶、过滤. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com