
 表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用元素符号或化学用语回答下列问题:
表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用元素符号或化学用语回答下列问题:| 族 周期 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
分析 由元素在周期表中位置,可知①为H、②为C、③为N、④为O、⑤为Na、⑥为Al、⑦为Si、⑧为Cl.
(1)可以利用氢化物稳定性、最高价含氧酸的酸性等判断非金属性强弱;
(2)①、④、⑤三种元素组成化合物为NaOH;
(3)离子的电子层结构相同,核电荷数越大离子半径越小;
(4)①、②、⑧三种元素按原子个数之比为11:5:1组成的有机化合物为C5H11Cl,可以看作戊烷被氯原子取代;
(5)利用最高价含氧酸的酸性强弱,证明碳、氮、硅的非金属性强弱关系,溶液a为硝酸,固体a为碳酸盐,溶液b为饱和NaHCO3溶液,除去挥发出的硝酸,溶液c为硅酸钠溶液.
解答 解:由元素在周期表中位置,可知①为H、②为C、③为N、④为O、⑤为Na、⑥为Al、⑦为Si、⑧为Cl.
(1)A.Na2CO3+SiO2$\frac{\underline{\;高温\;}}{\;}$Na2SiO3+CO2↑ 为高温固体之间的反应,不能比较非金属性,故A错误;
B.SiO2+2C$\frac{\underline{\;高温\;}}{\;}$ Si+2CO↑中C的还原性大于Si的还原性,不能比较C、Si的非金属性,故B错误;
C.Na2SiO3+CO2+2H2O═H2SiO3↓+Na2CO3,发生强酸制取弱酸的反应,可知C的非金属性较强,故C正确;
D.氢化物稳定性与元素非金属性一致,CH4比SiH4稳定说明碳的非金属性比Si的强,故D正确.
故选:CD;
(2)①、④、⑤三种元素组成化合物为NaOH,含有离子键、共价键,
故答案为:离子键、共价键;
(3)离子的电子层结构相同,核电荷数越大离子半径越小,故离子半径:O2->Na+>Al3+,
故答案为:O2->Na+>Al3+;
(4)①、②、⑧三种元素按原子个数之比为11:5:1组成的有机化合物为C5H11Cl,可以看作戊烷被氯原子取代,含有两个-CH3的同分异构体有:CH3CHClCH2CH2CH3,CH3CH2CHClCH2CH3,ClCH2CH2CH(CH3)2,CH3CH2CH(CH3)CH2Cl,
故答案为:4;
(5)利用最高价含氧酸的酸性强弱,证明碳、氮、硅的非金属性强弱关系,溶液a为硝酸,固体a为碳酸盐,溶液b为饱和NaHCO3溶液,除去挥发出的硝酸,溶液c为硅酸钠溶液,溶液c中的离子反应方程式为:SiO32-+CO2+H2O=H2SiO3↓+CO32-或SiO32-+2CO2+2H2O=H2SiO3↓+2HCO3-,
故答案为:①硝酸;饱和NaHCO3溶液;②SiO32-+CO2+H2O=H2SiO3↓+CO32-或SiO32-+2CO2+2H2O=H2SiO3↓+2HCO3-.
点评 本题考查结构性质位置关系应用,熟练掌握元素周期表结构,掌握金属性、非金属性强弱比较实验事实.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
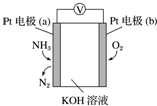 电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如图.下列说法不正确的是( )
电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如图.下列说法不正确的是( )| A. | O2在电极b上发生还原反应 | |
| B. | 溶液中OH-向电极a移动 | |
| C. | 反应消耗的NH3与O2的物质的量之比为4:5 | |
| D. | 负极的电极反应式为2NH3-6e-+6OH-═N2+6H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
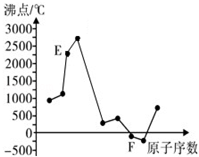 A、B、C、D、E、F是元素周期表中前20号元素,它们的原子序数依次增大.A、B可分别与C组成常见化合物AC、AC2、BC、BC2;D元素的焰色反应呈黄色;E、F两元素单质的沸点与元素原子序数的关系如图(图中原子序数连续).
A、B、C、D、E、F是元素周期表中前20号元素,它们的原子序数依次增大.A、B可分别与C组成常见化合物AC、AC2、BC、BC2;D元素的焰色反应呈黄色;E、F两元素单质的沸点与元素原子序数的关系如图(图中原子序数连续).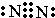 ,化合物AC2的结构式O=C=O;C、D、F对应的简单离子半径由小到大的顺序为Na+<O2-<Cl-(用离子符号表示).
,化合物AC2的结构式O=C=O;C、D、F对应的简单离子半径由小到大的顺序为Na+<O2-<Cl-(用离子符号表示).查看答案和解析>>
科目:高中化学 来源: 题型:实验题
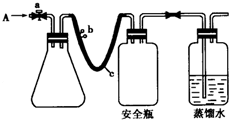 实验室用如图方法测定某水样中O2的含量.
实验室用如图方法测定某水样中O2的含量.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com