
下列关于除去物质中杂质的方案设计,所选除杂试剂合理的是( )
主要物质杂质除杂试剂
ASiO2Al2O3盐酸
BSiC氧气
CCO2SO2Na2CO3溶液
DCl2HClNaOH溶液
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题5化学反应中的能量变化练习卷(解析版) 题型:填空题
(1)在焙烧炉中发生反应:
①Fe2O3(s)+3C(s) 2Fe(s)+3CO(g) ΔH=-492.7 kJ·mol-1
2Fe(s)+3CO(g) ΔH=-492.7 kJ·mol-1
②3CO(g)+Fe2O3(s) 2Fe(s)+3CO2(g) ΔH=+25.2 kJ·mol-1
2Fe(s)+3CO2(g) ΔH=+25.2 kJ·mol-1
反应2Fe2O3(s)+3C(s) 4Fe(s)+3CO2(g) ΔH=________kJ·mol-1。
4Fe(s)+3CO2(g) ΔH=________kJ·mol-1。
(2)天然气(以甲烷计)在工业生产中用途广泛。甲烷蒸汽转化法制H2的主要转化反应如下:
CH4 (g)+H2O(g) CO(g)+3H2(g) ΔH=+206.2 kJ·mol-1
CO(g)+3H2(g) ΔH=+206.2 kJ·mol-1
CH4(g)+2H2O(g) CO2(g)+4H2(g) ΔH=+165.0 kJ·mol-1
CO2(g)+4H2(g) ΔH=+165.0 kJ·mol-1
上述反应所得原料气中的CO能使氨合成催化剂中毒,必须除去。工业上常采用催化剂存在下CO与水蒸气反应生成易除去的CO2,同时又可制得等体积的氢气的方法。此反应称为一氧化碳变换反应,该反应的热化学方程式是_________________________________________。
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题16物质结构与性质练习卷(解析版) 题型:填空题
许多金属及它们的化合物在科学研究和工业生产中具有许多用途。
回答下列有关问题:
(1)基态Ni的核外电子排布式为__________________________________________,
第二周期基态原子未成对电子数与Ni相同且电负性最小的元素是________。
(2)配合物Ni(CO)n的中心原子价电子数与配体提供电子总数之和为18,则n=________,CO与N2结构相似,CO分子内σ键与π键个数之比为________。
(3)NiO、FeO的晶体结构类型均与氯化钠的相同。
①Ni2+和Fe2+的离子半径分别为69 pm和78 pm,则熔点NiO________FeO(填“<”或“>”);
②NiO晶体中Ni的配位数为________。
(4)金属Cu单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,其原因是________________________________________________________________________________________________________________________________________________,
反应的离子方程式为________________________________________________________________________。
(5)一种铜金合金晶体具有面心立方最密堆积的结构。在晶胞中,Au原子位于顶点,Cu原子位于面心,则该合金中Au原子与Cu原子个数之比为________,若该晶胞的边长为a pm,则合金的密度为________g·cm-3(只要求列算式,不必计算出数值,阿伏加德罗常数为NA)。
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题14综合实验与探究练习卷A(解析版) 题型:选择题
用下列装置能达到有关实验目的的是( )
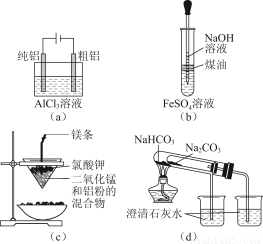
A.用图(a)装置电解精炼铝
B.用图(b)装置制备Fe(OH)2
C.图(c)装置只可制得金属钾
D.图(d)验证NaHCO3和Na2CO3的热稳定性
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题13化学实验基础练习卷(解析版) 题型:选择题
下列对Ⅰ~Ⅳ实验的现象预测正确的是( )
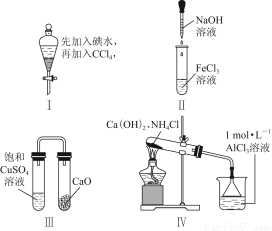
A.实验Ⅰ:振荡后静置,液体分层,下层液体无色
B.实验Ⅱ:滴入氢氧化钠溶液后,试管中出现白色沉淀,白色沉淀迅速变为灰绿色,最后变为红褐色
C.实验Ⅲ:一段时间后,饱和CuSO4溶液中出现蓝色晶体
D.实验Ⅳ:加热后,水槽中先生成白色沉淀,后逐渐溶解
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题12有机物的结构与性质练习卷(解析版) 题型:填空题
某学习小组欲模拟从某工厂废液中回收丙酮、乙醇和乙酸的实验。制定了如下试验流程。
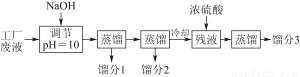
已知该废液中主要含有乙醇,其中还溶有丙酮、乙酸和乙酸乙酯。且各种成分的沸点如下表:
物质 | 丙酮 | 乙酸乙酯 | 乙醇 | 乙酸 |
沸点(℃) | 56.2 | 77.06 | 78 | 117.9 |
(1)馏分3的成分为____________。
(2)上述流程中调节pH=10的目的是________________________________________________________________________________________________________________________________________________。
(3)该小组同学的蒸馏装置如图所示。则A中温度计的位置正确的是________(填“a”“b”或“c”)。
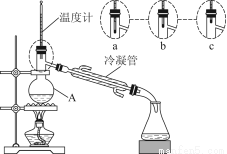
(4)国家标准规定,优质高度浓香型白酒总酸量(以乙酸计)应不少于0.30 g/L,总酯量(以乙酸乙酯计)应不少于2.0 g/L。
①为测定某白酒样品的总酸量,取20.00 mL样品于锥形瓶中,加入酚酞指示剂2滴,用0.010 mol/L的NaOH标准溶液滴定至终点。判断终点的依据是________________________________________________________________________________________________________________________________________________。
若该白酒样品为优质级,则消耗NaOH溶液体积应不小于________mL。
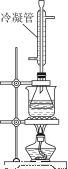
②白酒中的总酯量可用返滴法测定。往上题滴定后的溶液(恰好至终点)中再加入20.00mL0.100mol/L NaOH标准溶液,用图装置水浴加热半小时。冷却后用0.100mol/L的硫酸标准溶液滴定至终点。加热半小时的目的是______________________,冷凝管的作用是______________。已知最终消耗硫酸标准溶液7.70 mL,该白酒样品中总酯量为________g/L(保留小数点后三位数字)。
(5)下列操作会使总酯量测定结果偏高的是________(选填编号)
a.加热时未使用水浴和冷凝管
b.滴定前滴定管内无气泡,滴定后产生气泡
c.滴定管未用硫酸标准溶液润洗
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题11金属元素单质及化合物练习卷(解析版) 题型:填空题
合成氨工业生产中所用的α?Fe催化剂的主要成分是FeO、Fe2O3。
(1)某FeO、Fe2O3混合物中,铁、氧的物质的量之比为4∶5,其中Fe2+与Fe3+物质的量之比为________。
(2)当催化剂中Fe2+与Fe3+的物质的量之比为1∶2时,其催化活性最高,此时铁的氧化物混合物中铁的质量分数为________(用小数表示,保留2位小数)。
(3)以Fe2O3为原料制备上述催化剂,可向其中加入适量碳粉,发生如下反应:2Fe2O3+C 4FeO+CO2↑。
4FeO+CO2↑。
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题十电解质溶液练习卷(解析版) 题型:选择题
常温下,向20.00 mL 0.100 mol·L-1 CH3COONa溶液中逐滴加入0.100 0 mol·L-1盐酸,溶液的pH与所加盐酸体积的关系如下图所示(不考虑挥发)。下列说法正确的是( )

A.点①所示溶液中:c(CH3COOH)=c(Cl-)>c(OH-)=c(H+)
B.点②所示溶液中:c(Na+)>c(Cl-)>c(CH3COO-)>c(CH3COOH)
C.点③所示溶液中:c(CH3COOH)>c(Na+)>c(H+)>c(CH3COO-)
D.整个过程中可能出现:c(H+)+c(Na+)=c(CH3COOH)+c(CH3COO-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com