
【题目】常温常压下电解法合成氨的原理如图所示。下列说法中错误的是( )
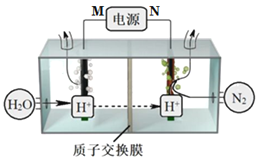
A.M为外接电源的正极
B.右室电极反应式为N2+6H++6e-=2NH3
C.理论上左、右室产生的气体同温同压下体积比为3︰4
D.该合成氨反应是化合反应、放热反应
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,其中A、C、D、E为短周期元素,最外层电子数之和为23,下列说法正确的是
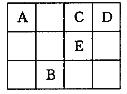
A.元素A的氢化物,在同族元素中沸点最低
B.元素B的金属性比E弱
C.A、C、D均可形成18e-分子
D.与金属钠的反应中,1mol C原子和1 mol E原子得电子数目一定相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环丁基甲酸是重要的有机合成中间体,如图是用烯烃A和羧酸D合成环丁基甲酸的路线。
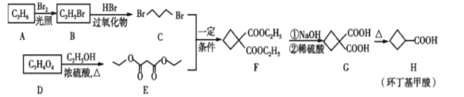
请回答下列问题:
(1)A的结构简式为____。
(2)B中官能团的名称为____、____。
(3)B→C的反应类型为____。D→E的反应类型为__________
(4)C+E→F的化学方程式为________
(5)满足下列条件的H的所有同分异构体(不考虑立体异构)共有____种,其中核磁共振氢谱有3组峰的结构简式为____。
①能使溴的四氯化碳溶液褪色
②能与NaOH溶液反应
③能与银氨溶液发生银镜反应
④不含环状结构
(6)以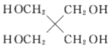 和
和![]() 为原料,选用必要的无机试剂,写出合成
为原料,选用必要的无机试剂,写出合成![]() 的路线________(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)
的路线________(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镇痛药物J的合成方法如下:

已知:
![]() +Cl-R3
+Cl-R3![]()
![]() +HCl
+HCl
R1COOR2+R3CH2COOR4![]()
![]() +R2OH
+R2OH
![]()
![]()
![]()
(R1、R2、R3、R4为氢或烃基)
(1)B的名称为______;F的结构简式为______。
(2)C中含氧官能团名称为______;②的反应类型为______反应。
(3)③的化学方程式为______。
(4)有机物K分子组成比F少两个氢原子,符合下列要求的K的同分异构体有______种。
A.遇FeCl3显紫色 B.苯环上有三个取代基
(5)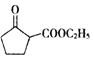 是一种重要的化工中间体。以环已醇(
是一种重要的化工中间体。以环已醇(![]() )和乙醇为起始原料,结合己知信息选择必要的无机试剂,写出
)和乙醇为起始原料,结合己知信息选择必要的无机试剂,写出 的合成路线______。(已知:RHC=CHR
的合成路线______。(已知:RHC=CHR![]() RCOOH+R′COOH,R、R′为烃基。用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)
RCOOH+R′COOH,R、R′为烃基。用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三位分别来自法国、美国、荷兰的科学家因研究“分子机器的设计与合成”而获得2016年诺贝尔化学奖。纳米分子机器日益受到关注,机器的“车轮”常用组件如图。下列说法不正确的是( )
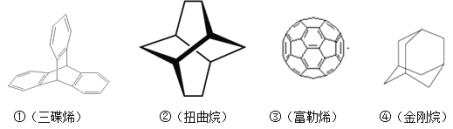
A.①③均能发生加成反应
B.②④互为同分异构体
C.①②③④均属于烃
D.①②④的一氯代物分别为3种、3种、2种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:MOH碱性比NOH强。常温下,用HCl气体分别改变浓度均为0.1mol·L-1的MOH溶液和NOH溶液的pH(溶液体积变化忽略不计),溶液中M+、N+的物质的量浓度负对数与溶液的pH关系如下图,pR=-lgc(M+)或-lgc(N+),下列说法错误的是( )
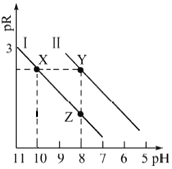
A.曲线I表示-lgc(M+)与pH关系
B.常温下,电离常数![]() =100
=100
C.溶液中水的电离程度:Y>X
D.对应溶液中c(Cl-):Y>Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.2mol两种气态烃组成的混合气体,完全燃烧后得到6.72L二氧化碳(标准状况下)和7.2g水,下列说法正确的是( )
A.一定有乙烯烯B.一定有甲烷
C.一定没有甲烷D.一定没有乙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钛因为其优越的性能被称为“未来金属”,其工业冶炼涉及到的反应如下:TiO2+2C+2Cl2 TiCl4+2CO。回答下列相关问题:
TiCl4+2CO。回答下列相关问题:
(1)基态钛原子的价层电子排布式为____ ,上述反应中非金属元素电负性由大到小是______;
(2)已知部分物质熔沸点如下:
名称 | 金红石 | 金刚石 | 四氯化钛 | 四溴化钛 | 四碘化钛 |
化学式 | TiO2 | C | TiCl4 | TiBr4 | TiI4 |
熔点/℃ | 1830 | 3550 | -24.1 | 38 | 150 |
沸点/℃ | 2927 | 4827 | 136.4 | 233.1 | 377.2 |
自左向右,表中的三种钛的卤化物熔沸点依次升高的原因是__________。
(3)配位数为6,组成为TiCl36H2O 的晶体有两种:化学式为[TiCl(H2O)5]Cl2H2O的X呈绿色,定量实验表明,X与AgNO3以1:2物质的量比反应生成沉淀。Y呈紫色,且Y与AgNO3 以1:3物质的量之比反应生成沉淀,则Y的化学式为 ______。
(4)钙钛矿是重要的含钛矿物之一。其主要成分Z 的晶胞如图所示。推测Z的化学式为__________,Ca填充在O围成的_________空隙中。
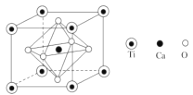
(5)若晶胞参数 a=384.1pm,Z晶体的密度为 _________列出计算表达式并计算出两位有效数字结果,3.8413≈56.67,阿伏加德罗常数用 6.0×1023 mol-1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)![]() 溶液显酸性,试用离子方程式解释其原因________。
溶液显酸性,试用离子方程式解释其原因________。
(2)氯化银在水中存在沉淀溶解平衡:AgCl(s)Ag+(aq)+Cl-(aq),在25C时,氯化银的![]() ,现将足量氯化银分别放入:①
,现将足量氯化银分别放入:①![]() 氯化镁溶液中,②
氯化镁溶液中,②![]() 硝酸银溶液中,③
硝酸银溶液中,③![]() 氯化铝溶液中,④
氯化铝溶液中,④![]() 盐酸溶液中。充分搅拌后,相同温度下银离子浓度由大到小的顺序是___________(填写序号)。
盐酸溶液中。充分搅拌后,相同温度下银离子浓度由大到小的顺序是___________(填写序号)。
(3)下表所示的是常温下,某些弱酸的电离常数,请根据要求作答。
弱酸 | 电离常数 | 弱酸 | 电离常数 |
|
|
|
|
|
|
|
|
①相同物质的量浓度的![]() 和
和![]() 的混合溶液中离子浓度由大到小的顺序为_________。
的混合溶液中离子浓度由大到小的顺序为_________。
②请判断![]() 溶液显_________性(填“酸”、“碱”或“中”)。
溶液显_________性(填“酸”、“碱”或“中”)。
③下列离子方程式书写正确的是_______。
A. HC2O4-+SO32-═HSO3-+C2O42-
B. 2CH3COOH+SO32-═2CH3COO-+H2O+SO2↑
C. SO2+H2O+2CH3COO-═2CH3COOH+SO32-
D. 2CO32-+SO2+H2O═2HCO3-+SO32-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com