
用Pt作电极,电解含c(Cu2+)∶c(Na+)∶c(Cl-)=1∶2∶4的混合溶液,在任何情况下,阴、阳两极下不可能同时发生的反应是( )
A.阴极:2H++2e-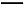 H2↑ 阳极:4OH--4e-
H2↑ 阳极:4OH--4e-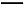 2H2O+O2↑
2H2O+O2↑
B.阴极:2H++2e-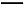 H2↑ 阳极:2Cl--2e-
H2↑ 阳极:2Cl--2e-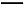 Cl2↑
Cl2↑
C.阴极:Cu2++2e-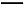 Cu 阳极:4OH--4e-
Cu 阳极:4OH--4e-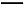 2H2O+O2↑
2H2O+O2↑
D.阴极:Cu2++2e-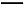 Cu 阳极:2Cl--2e-
Cu 阳极:2Cl--2e-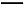 Cl2↑
Cl2↑
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2014高考化学名师高考模拟演练练习卷(B)(解析版) 题型:选择题
研究人员研制出一种锂水电池,可作为鱼雷和潜艇的储备电源。电池以金属锂和钢板为电极材料,LiOH为电解质,使用时加入水即可放电。关于该电池的说法正确的是( )
A.钢板为正极,发生还原反应
B.放电时电子的流向:正极→导线→负极
C.放电时OH-向正极移动
D.总反应为:2Li+2H+ 2Li++H2↑
2Li++H2↑
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师选择题专练 电解质溶液练习卷(解析版) 题型:选择题
下列说法正确的是( )
A.AlCl3溶液和NaAlO2溶液分别加热、蒸发、浓缩、结晶、灼烧,所得固体的成分相同
B.配制FeCl3溶液时,将FeCl3固体溶解在硫酸中,然后再用水稀释到所需的浓度
C.用加热的方法可除去KNO3溶液中混有的Fe3+
D.泡沫灭火器中常使用的原料是碳酸钠和硫酸铝
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师选择题专练 实验基础练习卷(解析版) 题型:选择题
下列实验中操作及现象与结论对应关系正确的一组是( )
实验操作实验现象实验结论
A在铁粉和铝粉中加入过量的氢氧化钠溶液,完全反应后过滤产生白色沉淀可以除去铁粉中混有的少量铝粉
B二氧化硫通入溴水中溶液褪色二氧化硫有漂白性
C向某溶液中加入NaOH并微热产生能够使湿润的红色石蕊试纸变蓝的无色气体该溶液中一定含有N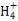
D淀粉和稀硫酸混合共热后,再加少量新制氢氧化铜悬浊液产生砖红色沉淀淀粉水解可生成葡萄糖
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师选择题专练 实验基础练习卷(解析版) 题型:选择题
在实验室进行下列实验, 括号内的实验用品都能用到的是( )
A.硫酸铜晶体里结晶水含量的测定(坩埚、温度计、硫酸铜晶体)
B.蛋白质的盐析(试管、醋酸铅溶液、鸡蛋白溶液)
C.钠的焰色反应(铂丝、氯化钠溶液、稀盐酸)
D.肥皂的制取(蒸发皿、玻璃棒、甘油)
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师选择题专练 化学反应中的能量变化练习卷(解析版) 题型:选择题
下列表示物质变化的化学用语中,正确的是( )
A.碱性氢氧燃料电池的负极反应式为O2+2H2O+4e- 4OH-
4OH-
B.用惰性电极电解饱和食盐水时,阳极的电极反应式为2Cl--2e- Cl2↑
Cl2↑
C.表示乙炔燃烧热的热化学方程式:C2H2(g)+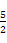 O2(g)
O2(g) 2CO2(g)+H2O(g) ΔH=-1 256 kJ/mol
2CO2(g)+H2O(g) ΔH=-1 256 kJ/mol
D.M与N互为同素异形体,由M N ΔH=+119 kJ/mol可知,N比M稳定
N ΔH=+119 kJ/mol可知,N比M稳定
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师选择题专练 化学与STSE练习卷(解析版) 题型:选择题
化学已经渗透到人类生活的各个方面,下列说法正确的是( )
A.绿色化学的核心是对环境污染进行综合治理
B.烟、云、雾在阳光照射下可观察到丁达尔现象
C.“温室效应”“酸雨”的形成都与氮氧化合物有关
D.高纯度的硅单质广泛用于制作光导纤维,光导纤维遇强碱会“断路”
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师选择题专练 元素周期表元素周期律练习卷(解析版) 题型:选择题
下列说法错误的是( )
A.原子最外层电子数为2的元素一定处于周期表ⅡA族
B.主族元素X、Y能形成XY2型化合物,则X与Y的原子序数之差可能为2或5
C.L层电子为奇数的所有元素所在族的序数与该元素原子的L层电子数相等
D.M层电子为奇数的所有主族元素所在族的序数与该元素原子的M层电子数相等
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师综合题专练 化学反应原理练习卷(解析版) 题型:填空题
随着大气污染的日趋严重,“节能减排”,减少全球温室气体排放,研究NOx、SO2、CO等大气污染气体的处理具有重要意义。
(1)如图是在101 kPa、298 K条件下1 mol NO2和1 mol CO反应生成1 mol CO2和1 mol NO过程中能量变化示意图。
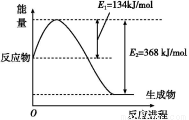
已知:N2(g)+O2(g)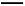 2NO(g) ΔH=+179.5 kJ/mol
2NO(g) ΔH=+179.5 kJ/mol
2NO(g)+O2(g)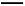 2NO2(g) ΔH=-112.3 kJ/mol
2NO2(g) ΔH=-112.3 kJ/mol
则在298 K时,反应:2NO(g)+2CO(g)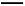 N2(g)+2CO2(g)的ΔH= 。
N2(g)+2CO2(g)的ΔH= 。
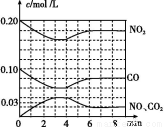
(2)将0.20 mol NO2和0.10 mol CO 充入一个容积恒定为1 L的密闭容器中发生反应,在不同条件下,反应过程中部分物质的浓度变化状况如图所示。
①下列说法正确的是 (填序号)。
a.容器内的压强不发生变化说明该反应达到平衡
b.当向容器中再充入0.20 mol NO时,平衡向正反应方向移动,K值增大
c.升高温度后,K值减小,NO2的转化率减小
d.向该容器内充入He气,反应物的体积减小,浓度增大,所以反应速率增大
②计算产物NO2在0~2 min时平均反应速率v(NO2)= mol/(L·min)。
③第4 min时改变的反应条件为 (填“升温”或“降温”)。
④计算反应在第6 min时的平衡常数K= 。若保持温度不变,此时再向容器中充入CO、NO各0.060 mol,平衡将 移动(填“正向”、“逆向”或“不”)。
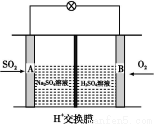
(3)有学者想以如图所示装置用原电池原理将SO2转化为重要的化工原料。其负极的反应式为 ,当有0.25 mol SO2被吸收,则通过质子(H+)交换膜的H+的物质的量为 。
(4)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9。现将2×10-4 mol/L的Na2CO3溶液与一定浓度的CaCl2溶液等体积混合生成沉淀,计算应加入CaCl2溶液的最小浓度为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com