
| A.第 IA 族元素铯的两种同位素137Cs 比133Cs 多 4 个质子 |
| B.同周期元素(除 0 族元素外)从左到右,原子半径逐渐减小 |
| C.第ⅦA 元素从上到下,其氢化物的稳定性逐渐增强 |
| D.同主族元素从上到下,单质的熔点逐渐降低 |
科目:高中化学 来源:不详 题型:单选题
| A.BA2 | B.BA3 | C.A3B2 | D.B3A2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
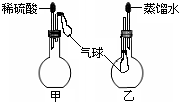
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| 元素编号 | 元素性质或原子结构 |
| T | 能形成双原子分子,原子间存在3对共用电子对 |
| X | M层有3个电子 |
| Y | 最外层电子数是最内层电子数2倍,其最高氧化物是一种固体,用于生产光导纤维 |
| Z | 最高正价为+7价 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:河西区一模 题型:单选题
| A.若R2-和M+的电子层结构相同.则离子半径R2-<M+ |
| B.标准状况下,11.2 L氮气和氧气的混合气所舍原子数约为6.02×1023 |
| C.PH3和HCI各原子最外层均满足8电子结构,且都是含有18个电子的分子 |
| D.将AgCl和AgBr的饱和溶液等体积混合,再加入足量浓AgNO3溶液,只有AgBr沉淀的生成 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com