
 氮元素可形成卤化物、叠氮化物及配合物等
氮元素可形成卤化物、叠氮化物及配合物等分析 (1)NF3的沸点-129℃,符合分子晶体的性质;
(2)①原子总数相等、价电子总数也相等的微粒互为等电子体,等电子体的结构相似;
②钴原子核外电子数为27,根据能量最低原理书写基态时的价电子排布式;
[Co(N3)(NH3)5]SO4中配体为N3-、NH3;
CN-中C原子价层电子对数=1+$\frac{4+1-3}{2}$=2,杂化轨道数目为2;
(3)A.离子半径越小,晶格能越大;
B.同主族自上而下第一电离能减小,P元素原子3p轨道为半满稳定状态,能量较低,第一电离能高于同周期相邻元素的;
C.钠晶胞结构为体心立方密堆积,根据均摊法计算晶胞中分摊钠原子数目;
D.氮气性质稳定是由于氮气分子中含有氮氮三键.
解答 解:(1)NF3的沸点-129℃,沸点很低,属于分子晶体,
故答案为:分子;
(2)①与N3-互为等电子体的微粒含有3个原子、16个价电子,与其等电子体的分子有N2O或CO2或CS2或BeCl2等,N3-与CO2是等电子体,具有相同的价电子数,它们具有相似的化学结构,二氧化碳是直线型分子,所以N3-的空间构型是直线形,
故答案为:N2O或CO2或CS2或BeCl2;直线;
②钴原子核外电子数为27,其基态原子核外电子排布式为1s22s22p63s23p63d74s2,价电子排布式为3d74s2,
[Co(N3)(NH3)5]SO4中配体为N3-、NH3,钴的配位数为6,
CN-中C原子价层电子对数=1+$\frac{4+1-3}{2}$=2,杂化轨道数目为2,C原子采取sp杂化;
故答案为:3d74s2;6;sp;
(3)A.离子电荷相同,钠离子半径小于钾离子半径,故NaN3的晶格能大于KN3的晶格能,故A错误;
B.同主族自上而下第一电离能减小,P元素原子3p轨道为半满稳定状态,能量较低,第一电离能高于同周期相邻元素的,故第一电离能N>P>S,故B正确;
C.钠晶胞结构为体心立方密堆积,晶胞中原子数为1+8×$\frac{1}{8}$=2,故C正确;
D.氮气分子中含有氮氮三键,键能较大,所以性质稳定,故D错误.
故选:BC.
点评 本题是对物质结构与性质的考查,涉及晶体类型与性质、核外电子排布、等电子体、配合物、杂化方式与空间构型、晶胞计算、电离能等,需要学生具备扎实的基础,注意同周期主族元素第一电离能异常考勤.


 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案科目:高中化学 来源: 题型:选择题
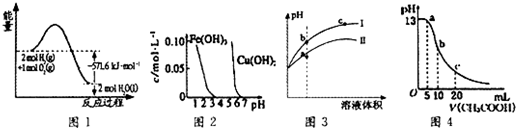
| A. | 图1表示H2与O2发生反应过程中的能量变化,H2的燃烧热为285.8 kJ/mol | |
| B. | 由图2得出若除去CuSO4溶液中的Fe3+,可采用向溶液中加入适量CuO,调节溶液的pH至4左右 | |
| C. | 图3表示用水稀释pH相同的盐酸和醋酸时溶液的pH变化曲线,其中Ⅰ表示醋酸,Ⅱ表示盐酸,且溶液导电性:c>b>a | |
| D. | 图4表示常温下向体积为10 mL0.1 mol/LNaOH溶液中逐滴加入0.1 mol/LCH3COOH溶液后溶液的pH变化曲线,则b点处有:c(CH3COOH)+c(H+)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
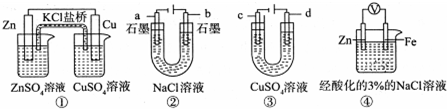
| A. | 装置①中,盐桥中的 K+移向CuSO4溶液 | |
| B. | 装置②在电解过程中,a极上得到22.4 L气体(标准状况),理论上需要转移NA个电子(NA表示阿伏加德罗常数) | |
| C. | 可以用装置③在铜上镀银,c极为银 | |
| D. | 装置④中一段时间后会有Fe(OH)2生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=7的NaHSO3与Na2SO3混合溶液中:3c(Na+)=c(HSO3-)+c(SO32-) | |
| B. | 0.1mol•L-1的KHA溶液,其PH=10:c(K+)>c(OH-)>c(HA-)>c(H+) | |
| C. | 20mL0.1mol•L-1醋酸钠溶液与10mL 0.1mol•L-1盐酸混合后的溶液中: 2 c(H+)+c(CH3COOH)=c(CH3COO-)+2 c(OH-) | |
| D. | 在25mL 0.1 mol•L-1NaOH溶液中逐滴加入0.2mol•L-1CH3COOH溶液,溶液pH变化如图所示,在A、B间任一点,溶液中一定都存在下列关系:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)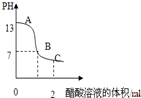 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 化学式 | HCOOH | H2CO3 | HClO |
| 电离平衡常数 | 1.7×10-4 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH═CH2与HBr | B. | 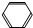 -CH3与混酸(浓HNO3和浓H2SO4,30℃) -CH3与混酸(浓HNO3和浓H2SO4,30℃) | ||
| C. | CH3CH═CHCH3与HBr | D. | 光照条件下CH3CH3与Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
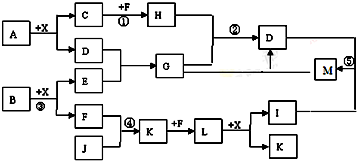
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com