
【题目】LiOH和钴氧化物可用于制备锂离子电池正极材料。利用如图装置电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液。下列说法不正确的是( )

A. B极区电解液为LiOH溶液
B. 电解过程中Li+向B电极迁移
C. 每产生标准状况下2.24L氢气,就有0.1mol阳离子通过交换膜进入阴极区
D. 阳极电极反应式为2Cl- - 2e-=Cl2↑
【答案】C
【解析】根据图知,B电极上有氢气生成,则B为电解池阴极,阴极电极反应式为2H2O+2e-=2OH-+H2↑,A为阳极,阳极反应式为2Cl--2e-=Cl2↑。
A、B为电解池阴极,阴极电极反应式为2H2O+2e-=2OH-+H2↑,所以B极区电解液为LiOH溶液,故A正确;B、电解过程中Li+向阴极B电极迁移,故B正确;C、每产生标准状况下2.24L氢气,所以有0.2mol电子转移,根据电荷守恒知,就有0.2mol阳离子通过交换膜进入阴极区,故C错误;D、A为阳极,电极上氯离子放电,电极反应式为2Cl--2e-=Cl2↑,故D正确;故选C。
点晴:本题考查电解原理,解题关键:理清各个电极上发生的反应、各个区域电解质溶液成分,会正确书写电极反应式,易错点:A选项,电解破坏了水的电离平衡,在阴极水电离的氢离子得电子生成氢气,留下OH-。


 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:高中化学 来源: 题型:
【题目】取NaCl和KCl的混合物25g,溶于水配成溶液,加入体积为1L 0.42mol·L-1的AgNO3溶液,充分反应后过滤出沉淀,再向滤液中加入100gCu片,反应完全后,取出Cu片,洗涤干燥称其重量为101.52g,求原混合物中NaCl和KCl的物质的量各为多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳及其化合物广泛存在于自然界中,回答下列问题:
(1) 碳在形成化合物时,其键型以共价键为主,原因是___________________________。
(2) (CN)2分子中,共价键的类型有________________,C原子的杂化轨道类型是____________
(3) CO能与金属Fe形成Fe(CO)5,该化合物熔点为253K,沸点为376K,其固体属于________晶体。
(4) 与碳同族的基态Ge原子的核外电子排布式为___________,有________个未成对电子。
(5) 石墨可用作锂离子电池的负极材料,充电时发生下述反应:Li1-xC6+xLi++xe→LiC6。其结果是:Li+嵌入石墨的A、B层间。现有某石墨嵌入化合物每个六元环都对应一个Li+,写出它的化学式:_______。

(6) 碳有多种同素异形体,其中金刚石的晶体晶胞如下图所示:
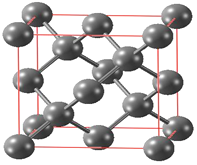
已知金刚石立方晶胞边长a pm,请计算晶体密度____________g/cm3(请用含a和NA的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有三组混合液:①乙酸乙酯和乙酸钠溶液;②乙醇和丁醇;③溴化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是( )
A. 分液、萃取、蒸馏 B. 萃取、蒸馏、分液
C. 分液、蒸馏、萃取 D. 蒸馏、萃取、分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应中常伴随着能量变化。将Al条打磨后,插入6 mol/L盐酸中。
(1)Al与盐酸反应的离子方程式是________。
(2)该反应的能量变化可用下图中的________表示(填序号)。

(3)H2的产生速率随时间的变化如图所示。

t1~t2速率变化的主要原因是________。
t2~t3速率变化的主要原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 常温下,pH=4.3的CH3NOOH和CH3COONa混合溶液中:c(Na+) > c(CH3COO-)
B. 根据Ksp (CaCO3)<Ksp (CaSO4),在生产中可用Na2CO3溶液处理锅炉水垢中的CaSO4,使之转化为疏松、易溶于酸的CaCO3
C. 常温下,将醋酸稀溶液加水稀释,醋酸电离程度增大,溶液导电能力增强
D. 已知反应:3H2(g)+WO3(s)![]() W(s)+3H2O(g)只有在高温时才能自发进行,则它的ΔS<0
W(s)+3H2O(g)只有在高温时才能自发进行,则它的ΔS<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关金属晶体判断正确的是
A.简单立方、配位数6、空间利用率68%
B.钾型、配位数6、空间利用率68%
C.镁型、配位数8、空间利用率74%
D.铜型、配位数12、空间利用率74%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤族元素的单质能与H2反应,反应情况如下表所示:
F2 | 在暗处能剧烈化合并发生爆炸,生成的氟化氢很稳定 |
Cl2 | 光照或点燃发生反应,生成的氯化氢较稳定 |
Br2 | 加热至一定温度才能反应,生成的溴化氢不如氯化氢稳定 |
I2 | 不断加热才能缓慢反应,同一条件下,生成的HI会分解 |
(1)卤族元素位于周期表中的_________族。
(2)用电子式表示HCl的形成过程________。
(3)依据上表,可以推测出:随着核电荷数的增加,________(填字母)。
a. 单质的熔沸点逐渐升高 b. 元素的非金属性逐渐减弱
c. 卤化氢的还原性依次减弱 d. 卤化氢的稳定性依次减弱
(4)I2与H2反应的化学方程式是________。
(5)不同卤素原子之间可形成卤素互化物,其性质与卤素单质相近。BrCl和FeCl2水溶液发生反应的化学方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.研究化学反应中的能量变化有重要意义。请根据学过的知识回答下列问题:
(1)已知一氧化碳与水蒸气反应过程的能量变化如图所示:该反应的热化学方程式为
________________________________
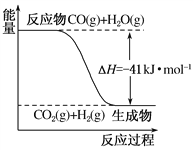
(2)已知:C(s)+H2O(g)===CO(g)+H2(g) ΔH=+131 kJ·mol-1,则C(s)+CO2(g)===2CO(g) ΔH=________。
(3)化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知:N≡N键的键能是948.9 kJ·mol-1,H—H键的键能是436.0 kJ·mol-1;N—H键的键能是391.55 kJ·mol-1。则1/2N2(g)+3/2H2(g)===NH3(g) ΔH=________。
Ⅱ.下图是一个化学过程的示意图,回答下列问题:
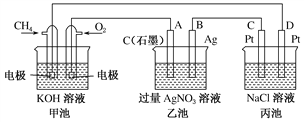
(1)甲池是________装置,乙装置中电极A的名称是____。
(2)甲装置中通入CH4的电极反应式为_______________________,乙装置中电极B(Ag)的电极反应式为_______________________
(3)一段时间,当丙池中产生112 mL(标准状况下)气体时,均匀搅拌丙池,所得溶液在25 ℃时的pH=________。(已知:NaCl溶液足量,电解后溶液体积为500 mL)。若要使丙池恢复电解前的状态,应向丙池中通入________(写化学式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com