
| A. | 2gO3和2 gO2 | B. | 9克H2O和0.5NA个CO2 | ||
| C. | 标准状况下1molO2和22.4LH2O | D. | 0.2molH2和4.48LHCl |
分析 含有分子数目相等,则其物质的量相等.
A.根据n=$\frac{m}{M}$计算判断;
B.根据n=$\frac{m}{M}$计算水的物质的量,根据n=$\frac{N}{{N}_{A}}$计算二氧化碳物质的量;
C.标况下水不是气体;
D.HCl所处的温度、压强未知.
解答 解:A.根据n=$\frac{m}{M}$可知,2gO3和2 gO2的物质的量之比为32g/mol:48g/mol=2:3,含有分子数目不相等,故A错误;
B.9g水的物质的量为$\frac{9g}{18g/mol}$=0.5mol,0.5NA个CO2的物质的量为0.5mol,二者含有分子数目相等,故B正确;
C.标况下水不是气体,22.4L水的物质的量远远大于1mol,故C错误;
D.HCl所处的温度、压强未知,不能确定4.48LHCl的物质的量是否为0.2mol,故D错误,
故选:B.
点评 本题考查物质的量有关计算,比较基础,注意气体摩尔体积的使用条件与对象.


科目:高中化学 来源: 题型:解答题
| 化学反应 | 平衡常温 | 温度(℃) | |
| 500 | 800 | ||
| ①2H2(g)+CO(g)?CH3OH(g) | K1 | 2.5 | 0.15 |
| ②H2(g)+CO2(g)?H2O(g)+CO(g) | K2 | 1.0 | 2.5 |
| ③3H2(g)+CO2(g)?CH3OH(g)+H2O(g) | K3 | ||

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去乙烷中少量的乙烯,可将混合气体通入酸性高锰酸钾溶液 | |
| B. | 除去苯中含有的少量苯酚,可加入浓溴水过滤,即可除去苯酚 | |
| C. | 乙酸乙酯中混有乙酸,可用饱和Na2CO3溶液洗涤,然后分液分离出乙酸乙酯 | |
| D. | 在提纯鸡蛋中的蛋白质时,可向鸡蛋清溶液中加入浓CuSO4溶液,然后滤出沉淀,即得较纯的蛋白质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生成 SO3 为2mol | |
| B. | 单位时间消耗amol O2,同时消耗2amol SO2 | |
| C. | SO2 和 SO3物质的量之和一定为 2mol | |
| D. | SO2和SO3的浓度一定相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
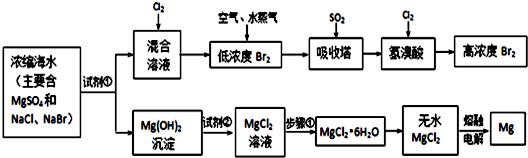
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有① | B. | 只有①②③ | C. | 只有②③ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. |  | B. | HC≡C-CH2-CH3 | C. | CH2=C(CH3)2 | D. | CH2=CHCH=CH2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com