
| A. | 有Al(OH)3、Fe(OH)3沉淀析出 | |
| B. | 所得混合液中:$\frac{c(A{l}^{3+})}{c(F{e}^{3+})}$=3.25×104 | |
| C. | 所得混合液中相关微粒的浓度大小:c(Cu2+)=c(Al3+)>c(Fe3+)>c(H+) | |
| D. | 若向原溶液中逐滴加入NaOH溶液,最后析出的是Cu(OH)2沉淀 |
分析 A.pH=3,则溶液中c(OH-)=10-11mol/L,根据Qc与Ksp的大小关系判断;
B.根据Ksp[Al(OH)3]=1.3×10-33mol4•L-4、Ksp[Fe(OH)3]=4.0×10-38mol4•L-4,计算溶液中的c(Al3+)与c(Fe3+),再求出$\frac{c(A{l}^{3+})}{c(F{e}^{3+})}$;
C.根据溶度积计算c(Cu2+)、c(Al3+)、c(Fe3+),再比较大小;
D.根据Ksp求出形成沉淀时溶液中c(OH-),c(OH-)小的先析出.
解答 解:A.pH=3,则溶液中c(OH-)=10-11mol/L,Qc[Al(OH)3]=1.0×10-2×(10-11)3=10-35<Ksp[Al(OH)3]=1.3×10-33mol4•L-4,所以没有Al(OH)3产生,
Qc[Fe(OH)3]=1.0×10-2×(10-11)3=10-35>Ksp[Fe(OH)3]=4.0×10-38mol4•L-4,所以有Fe(OH)3产生,故A错误;
B.由A分析可知,没有Al(OH)3产生,则c(Al3+)=1.0×10-2mol•L-1,溶液中c(Fe3+)=$\frac{Ksp[Fe(OH)_{3}]}{{c}^{3}(O{H}^{-})}$=$\frac{4.0×1{0}^{-38}}{(1{0}^{-11})^{3}}$=4.0×10-5mol/L,
$\frac{c(A{l}^{3+})}{c(F{e}^{3+})}$=$\frac{0.01}{4.0×1{0}^{-5}}$=1.25×10-4mol/L,故B错误;
C.Qc[Cu(OH)2]=1.0×10-2×(10-11)2=10-24<Ksp[Cu(OH)2]=2.2×10-20,所以有Cu(OH)2产生,溶液中c(Cu2+)不变,所以c(Cu2+)=c(Al3+),溶液中c(Fe3+)=4.0×10-5mol/L,c(H+)=10-3mol/L,则c(Cu2+)=c(Al3+)>c(H+)>c(Fe3+),故C错误;
D.开始生成Cu(OH)2沉淀时,c(OH-)=$\sqrt{\frac{2.2×1{0}^{-22}}{0.01}}$=$\sqrt{2.2}$×10-10mol/L,开始生成Al(OH)3沉淀时,c(OH-)=$\root{3}{\frac{1.3×1{0}^{-33}}{0.01}}$=$\root{3}{1.3}$×10-11mol/L,
c(OH-)小的先析出,所以最后析出的是Cu(OH)2沉淀,故D正确.
故选D.
点评 本题考查了沉淀溶解平衡的分析计算应用,侧重于学生的分析能力和计算能力的考查,解题的关键是明确溶度积的表达式以及溶液中氢氧根离子浓度,题目难度中等.


 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:解答题
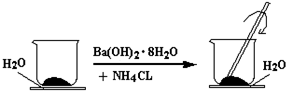
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
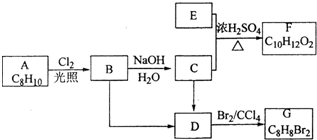 A~G都是有机化合物,它们的转化关系如图:
A~G都是有机化合物,它们的转化关系如图: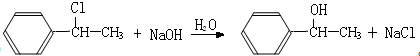 .
. (填结构简式).
(填结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 饱和(NH4)2SO4、CuSO4溶液都能使蛋白质溶液发生盐析 | |
| B. | 肥皂能去污的原理,是其在水溶液中能电离出钠离子(亲水基团)和硬脂酸根离子(亲油基团),在它们的共同作用下,通过搓洗,将衣服上的油污“拖下水” | |
| C. | 糖类、油脂和蛋白质都是天然高分子化合物 | |
| D. | 福尔马林、葡萄糖都能发生银镜反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇与乙酸发生酯化反应 | B. | 乙醇的催化氧化 | ||
| C. | 乙醇与钠反应生成氢气 | D. | 乙醇在浓硫酸存在下加热至170℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | W | Z | 反应体系能量变化 | |
| 甲 | 2mol | 1mol | 放出akJ/mol | ||
| 乙 | 1mol | 1mol | 放出bkJ/mol | ||
| 丙 | 2mol | 2mol | 放出ckJ/mol | ||
| 丁 | 3mol | 2mol | 吸收dkJ/mol |
| A. | c+d<Q | |
| B. | 平衡时,甲、丁容器中X、W的转化率之和大于1 | |
| C. | 平衡时丙容器中Z的物质的量浓度最大 | |
| D. | X的转化率为:甲<乙<丙 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3$→_{催化剂、加热}^{O_{2}}$NO2$\stackrel{H_{2}O}{→}$HNO3 | |
| B. | 海水$\stackrel{石灰乳}{→}$Mg(OH)2$\stackrel{HCi(aq)}{→}$MgCl2(aq)$\stackrel{△}{→}$ 无水MgCl2 | |
| C. | Al2O3$\stackrel{HCl(aq)}{→}$AlCl3(aq)$\stackrel{NH_{3}•H_{2}O}{→}$ 固体Al(OH)3 | |
| D. | CH2═CH2$→_{催化剂}^{H_{2}O}$CH3CH2OH$→_{△}^{CuO}$CH3COOH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com