
 ��ѧ������̫���ֽܷ�ˮ���ɵ������ڴ����������������̼��Ӧ���ɼ״�����������ֱ���Լ״�Ϊȼ�ϵ�ȼ�ϵ�أ���֪H2��g����CO��g����CH3OH��l ����ȼ���ȡ�H�ֱ�Ϊ-285.8kJ•mol-1��-283.0kJ•mol-1��-726.5kJ•mol-1����ش��������⣺
��ѧ������̫���ֽܷ�ˮ���ɵ������ڴ����������������̼��Ӧ���ɼ״�����������ֱ���Լ״�Ϊȼ�ϵ�ȼ�ϵ�أ���֪H2��g����CO��g����CH3OH��l ����ȼ���ȡ�H�ֱ�Ϊ-285.8kJ•mol-1��-283.0kJ•mol-1��-726.5kJ•mol-1����ش��������⣺���� ��1��������ȼ���ȿ�֪ˮ�ֽ����յ�������Ȼ�����û�ѧ�������뷴Ӧ�ȵĹ�ϵ�����㣻
��2������ͼ���м״��ı仯�����㷴Ӧ���ʣ�������ͼ����ʱ�������ʵĹ�ϵ������T1��T2��������Ӱ��ƽ����������������
��3�����ݻ�ѧƽ������η�����ƽ��ʱ�����ʵ����ʵ����������÷�Ӧǰ����������ʵ���֮�ȵ���ѹǿ֮�������
��� �⣺��1��H2��g����ȼ���ȡ�HΪ-285.8kJ•mol-1֪��1molH2��g����ȫȼ������1molH2O��l���ų�����285.8kJ�����ֽ�1mol H2O��l��Ϊ1mol H2��g�����ĵ�����Ϊ285.8kJ����ֽ�10mol H2O��l�����ĵ�����Ϊ285.8kJ��10=2858kJ��
�ʴ�Ϊ��2858��
��2���������ͼ�������֪��T2�ȴﵽƽ����T2��T1�����¶����߷�Ӧ���������֪T2�ķ�Ӧ���ʴ���T1�����¶ȸ�ʱƽ��״̬CH3OH�����ʵ����٣���˵�����淴ӦCO2+3H2?CH3OH+H2O���淴Ӧ�����ƶ���������ӦΪ���ȷ�Ӧ����T1ʱ��ƽ�ⳣ����T2ʱ�Ĵۡ�����ȷ�����и÷�Ӧ��T1ʱ��ƽ�ⳣ����T2ʱ�Ĵʢڴ����а�����������ʵķ�����֪��Ӧ���ʵĵ�λ����ӦΪmol•min-1���ʢٴ���
�ʴ�Ϊ���ۢܣ�
��3���ɻ�ѧƽ�������ģʽ�������֪��
CO2��g��+3H2��g��=CH3OH��g��+H2O��g��
��ʼ��mol����1 3 0 0
ת����mol����a 3a a a
ƽ�⣨mol����1-a 3-3a a a
������ͬ�����������ѹǿ֮�ȵ������ʵ���֮�ȣ�����1-a+3-3a+a+a������1+3��=$\frac{4-2a}{4}$=1-$\frac{a}{2}$��
�ʴ�Ϊ��1-$\frac{a}{2}$��
���� ���⿼���Ϊ�ۺϣ��漰�Ȼ�ѧ����ʽ����д����ѧƽ������֪ʶ���������Щ֪ʶ��Ҫ��Ƚϸߣ��ۺ���ǿ�������ȽϷ�ʱ�������ѶȽϴ�


 ����ѧ��ţ��Ӣ��ϵ�д�
����ѧ��ţ��Ӣ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��98%��1.84g/mL��Ũ��������1mol/L��500mL��ϡ����ʱ��Ӧ����Ͳ��ȡŨ����Լ27.17mL | |
| B�� | �ӵ�ˮ����ȡ�⣬���û�����Ȼ�̼�ͱ�����ʵҲ�����þƾ����� | |
| C�� | ����������ʹNaCl ����Һ������ʱ��Ӧ����������NaCl ��Һ���� | |
| D�� | ��ʯ������ȡ�ý����ƣ�����ȡ�����࣬Ϊ�˲��˷ѣ��ְѹ����Ľ����ƷŻ��Լ�ƿ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
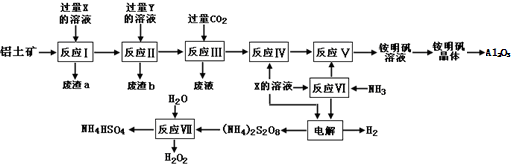
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����

| A�� | ��SO2����������������ˮ����ֱ���ŷſ�������Խ��� | |
| B�� | ��������������������H2SO3��HSO3-��SO32-����������SO42- | |
| C�� | ����Ӧ��ϡ�͡�ʱ����Ȼ��ˮ��Ŀ�����к͡�ϡ�;�������ˮ�����ɵ��� | |
| D�� | ���ŷš������ĺ�ˮ��SO42-�����ʵ���Ũ�����������������Ȼ��ˮ��ͬ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | CH4��C2H4��C3H4��������� | |
| B�� | CH4��C3H6��C2H2����C3H6��C2H2=1��2�����ʵ���֮�ȣ� | |
| C�� | CH4��C2H6��C3H8ͬ�����������Ϊ2��1��2 | |
| D�� | C2H4��C3H6��C4H8���������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | L���ϵĵ�����Ϊ������ԭ��һ��������Ԫ�ص�ԭ�� | |
| B�� | �˵�վй©�ķ���������131I��127I��Ϊͬλ�أ���ѧ�������� | |
| C�� | ��ѧ�����γ�һ�������ŵ��ӵ�ת�ƺ������仯 | |
| D�� | Ԫ�����ڱ��У�λ�ڽ����ͷǽ����ֽ��߸�����Ԫ�����ڹ���Ԫ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com