
����Ŀ�����ױ����������Ȼ���������Ӧһ��ˮ��Ϲ��գ������л��Ȼ����յĸ���Ʒ�Ȼ���Ϊԭ���Ʊ�������ʵ���ȵ�ѭ�����ã�ԭ��Ϊ4HCl��g��+O2��g��2Cl2��g��+2H2O��g������HC1��O2�ֱ���5�����ʵ����ȣ���1��1 ��2��1 ��4��1 ��6��1 ��8��1��������ݻ��ɱ��������Ͷ��ʱ����Ӧ�¶ȶ�HClƽ��ת����Ӱ���������ͼ�� 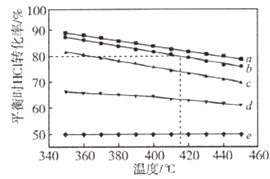
��ش��������⣺
��1�������жϸ÷�Ӧ�Ѿ��ﵽ��ѧƽ�����������ĸ����
A.�ܱ���������ѹǿ����
B.�ܱ������л��������ܶȲ���
C.v��HCl��=2v��Cl2��
D.�ܱ������К����������������
��2��d���߶�Ӧ��Ͷ�ϱ��������ֵ���������ѡ����ͬ�����л���ҵ��Ҫ��O2���͵��������Ȼ��������壬�ɿ���n��HCl����n��O2��=�Ʊ���
��3���÷�Ӧ��ƽ�ⳣ������ʽΪ ��
��4������b���߶�Ӧ��Ͷ�ϱȽ��з�Ӧ�����¶�Ϊ415�棬��Ӧ�ﵽƽ��ʱCl2���������Ϊ ��
��5�����������״�ȼ�ϵ�صĵ�������ڳ�Ϊ�ȵ���⣮�״�������һ����̼��������Ӧ���ɣ�����ΪCu2O/ZnO����
��֪��2CO��g��+O2��g���T2CO2��g����H=��566kJmol��1
CH3OH��g��+ ![]() O2��g���TCO2��g��+2H2��g����H=��182.9kJmol��1
O2��g���TCO2��g��+2H2��g����H=��182.9kJmol��1
�� CO��g��+2H2��g���TCH3OH��g����H= ��
�������ɵ�CH3OH�����ᡢ��������ȼ�ϵ�أ���ȼ�ϵ�صĸ�����ӦʽΪ
���𰸡�
��1��BD
��2��6��1��8��1
��3��![]()
��4��30.8%
��5����100.1KJ/mol��CH3OH+H2O��6e��=CO2+6H+
���������⣺��1��4HCl��g��+O2��g��2Cl2��g��+2H2O��g������Ӧ�����������С�ķ�Ӧ��
A���������ʵ��������仯�����ܱ���������ѹǿ���䣬˵����Ӧ�ﵽƽ��״̬����A��ȷ��
B�������������䣬������䣬�ܱ������л��������ܶ�ʼ�ղ��䣬��B����
C����Ӧ����֮�ȵ��ڻ�ѧ����ʽ������֮�ȣ�Ϊ����Ӧ����֮�ȣ�v��HCl��=2v��Cl2������˵�����淴Ӧ������ͬ������˵����Ӧ�ﵽƽ��״̬����C����
D���ܱ������К������������������ƽ���־����D��ȷ��
���Դ��ǣ�BD��
��2.����������������ʱ��O2����Խ��HCl��ת����Խ���ɴ˿�ȷ��aΪ1��1��bΪ2��1��cΪ4��1��dΪ6��1��eΪ8��1���л���ҵ��Ҫ��O2���͵��������Ȼ��������壬�ɿ���n��HCl����n��O2��=8��1��
���Դ��ǣ�6��1��8��1��
��3.��4HCl��g��+O2��g��2Cl2��g��+2H2O��g������Ӧ��ƽ�ⳣ��K= ![]() ��
��
���Դ��ǣ� ![]() ��
��
��4.����ͼ�ɶ���Ͷ�ϱ�Ϊ2��1���¶�Ϊ415��ʱ��HCl��ת����Ϊ80%����Ͷ���HClΪ2 mol��O2Ϊ1 mol���ɴ˿ɽ�������ʽ��
4HCl | + | O2 | = | 2Cl2 | + | 2H2O | |
n����ʼ��/mol | 2 | 1 | 0 | 0 | |||
n��ת����/mol | 1.6 | 0.4 | 0.8 | 0.8 | |||
n��ƽ�㣩/mol | 0.4 | 0.6 | 0.8 | 0.8 |
����ƽ��������Cl2�����ʵ�������= ![]() ��100%=30.8%��
��100%=30.8%��
���Դ��ǣ�30.8%��
��5.����2CO��g��+O2��g���T2CO2��g����H=��566kJmol��1
��CH3OH��g��+ ![]() O2��g���TCO2��g��+2H2��g����H=��182.9kJmol��1
O2��g���TCO2��g��+2H2��g����H=��182.9kJmol��1
�� ���ݸ�˹���ɼ��㣨�٩��ڡ�2���� ![]() �õ��Ȼ�ѧ����ʽΪ��CO��g��+2H2��g���TCH3OH��g����H=��100.1KJ/mol��
�õ��Ȼ�ѧ����ʽΪ��CO��g��+2H2��g���TCH3OH��g����H=��100.1KJ/mol��
�������ɵ�CH3OH�����ᡢ��������ȼ�ϵ�أ���ȼ�ϵ�صĸ�����ӦΪ�״�ȼ��ʧ�������ɶ�����̼�������缫��ӦΪ��CH3OH+H2O��6e��=CO2+6H+ ��
���Դ��ǣ���100.1KJ/mol��CH3OH+H2O��6e��=CO2+6H+��
�����㾫����ͨ��������û�ѧƽ��״̬���жϺͻ�ѧƽ��ļ��㣬����״̬�жϣ���v(B��)=v(B��)��v(C��):v(D��)=x : y��c(C)��C%��n(C)%�Ȳ������A��B��C��DΪ���壬��m+n��x+y��ѹǿ�㶨����ϵ��ɫ�����λʱ����ij�����ڻ�ѧ���Ķ����������γ�������ϵƽ��ʽ���㶨��m+n �� x+y���ȣ���Ӧ��ת����=ת��Ũ�ȡ���ʼŨ�ȡ�100%=ת�����ʵ�������ʼ���ʵ�����100%����Ʒ�IJ���=ʵ�����ɲ�������ʵ����������Ͽɵõ���������ʵ�����100%�����Խ����⣮


 ѧ���쳵�����ּ��ں�����ҵϵ�д�
ѧ���쳵�����ּ��ں�����ҵϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������������Ȼ�����Һ��ʵ�������(����)
A.���������������ӵ�ֱ����1��100 nm֮��
B.��������������ж����ЧӦ
C.�������������Ǿ�һ�ķ�ɢϵ
D.������������ķ�ɢ��������ֽ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
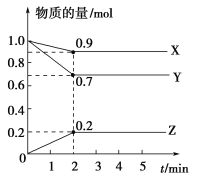
����Ŀ��ij�¶�ʱ����2 L������X��Y��Z������̬���ʵ����ʵ�����ʱ��ı仯������ͼ��ʾ����ͼ�����ݷ������÷�Ӧ�Ļ�ѧ����ʽΪ��________________����Ӧ��ʼ��2 min��Z��ƽ����Ӧ����Ϊ__________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڽ����к��ȵIJⶨ�У����в���������ǣ� ��
A.��Ӧǰ�ᡢ����Һ���¶�Ҫ��ͬ
B.������Һ���¶ȼ�Ҫһֱ������Һ��
C.Ϊ��ʹ��Ӧ���Ƚ��У��������ᣨ��зִμ����ᣩ
D.Ϊ��ʹ��Ӧ����ȫ������ʹ�����ʵ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������������ͭ�Ļ����m g�������м���100mL 3mol��L��1���ᣬǡ����ȫ�ܽ⣬��m g�û�����ڹ����������м��ȳ�ַ�Ӧ������ȴ��ʣ����������Ϊ �� ��
A. (m��1.6)g B. (m��2.4)g C. (m��3.2)g D. ��ȷ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��FeC13��CuCl2�Ļ��Һ�м������ۣ���ַ�Ӧ�����й�����ڣ��������жϲ���ȷ��( )
A. ����KSCN��Һһ�������ɫ B. ��Һ��һ����Fe2+
C. ��Һ��һ������Cu2+ D. ʣ�������һ����Cu
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������Ȼ�ѧ����ʽ��
��C(s)��O2(g)===CO2(g)����H1����393.5 kJ/mol
��H2(g)��![]() O2(g)===H2O(l)����H2����285.8 kJ/mol
O2(g)===H2O(l)����H2����285.8 kJ/mol
��CH3COOH(l)��2O2(g)===2CO2(g)��2H2O(l)����H3����870.3 kJ/mol
���Լ����2C(s)��2H2(g)��O2(g)===CH3COOH(l)�ķ�Ӧ��Ϊ(����)
A����H����244.1 kJ/mol B����H����488.3 kJ/mol
C����H����996.6 kJ/mol D����H����996.6 kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
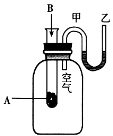
����Ŀ��I��Ϊ���о���ѧ��ӦA+B![]() C+D�������仯�����ijͬѧ�������ͼ��ʾװ�á�����ʢ��A���Թ��еμ��Լ�Bʱ������U�ι��м״�Һ���½��Ҵ�Һ��������
C+D�������仯�����ijͬѧ�������ͼ��ʾװ�á�����ʢ��A���Թ��еμ��Լ�Bʱ������U�ι��м״�Һ���½��Ҵ�Һ��������
�Իش�����������
��1���÷�ӦΪ_______��Ӧ(����ȡ������ȡ�)��
��2��A��B����������C��D��������_______(��ߡ��͡�)��
��3�������еĻ�ѧ��ͨ����ѧ��Ӧת����_______�ͷų�����
��4����Ӧ�ﻯѧ���������յ�����_______(��ߡ��͡�)�������ﻯѧ���γɷų���������
��5��д��һ���������������Ļ�ѧ����ʽ��_____________________��
����ͬ���������ת���ķ�Ӧ���൱С������ת�����ʽ�������ʱ���ܲ���ȫ���ⶨ��Ӧ�Ⱥ����ѡ����ڿɸ��ݸ�˹����ġ����ܻ�ѧ������һ����ɻ�ּ�����ɣ�����ܹ��̵���ЧӦ����ͬ�ġ��۵������㷴Ӧ�ȡ�
��֪��
P4(���ף�s)+5O2(g)![]() P4O10(s) ��H=2983.2 kJ��mol1 ��
P4O10(s) ��H=2983.2 kJ��mol1 ��
P(���ף�s)+ ![]() O2(g)
O2(g)![]()
![]() P4O10(s) ��H=738.5 kJ��mol1 ��
P4O10(s) ��H=738.5 kJ��mol1 ��
�����ת��Ϊ�����Ȼ�ѧ����ʽΪ______________����ͬ״���£�����״̬�ϵ͵���_______�������ȶ��ԱȺ���_______(��ߡ��͡�)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ҫ�����
��1������ͼ����Ȼ��Ƶ�ϡ��Һ���Ƶ�Ư��Һ��д���õ����з�����Ӧ���ܷ�Ӧ����ʽ���� 
��2������ֵ���������Һ��μ��뵽��̪��Һ�У��۲쵽�������� ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com