
| A. | 5mol•L-1 | B. | 9mol•L-1 | C. | 11mol•L-1 | D. | 12mol•L-1 |
分析 铜和一定量浓硝酸反应,铜完全溶解,反应生成气体的颜色逐渐变浅,得到的气体为NO和NO2,反应中硝酸起氧化剂与酸性作用,起酸性作用的硝酸生成Cu(NO3)2,起氧化剂作的硝酸得到NO和NO2,剩余硝酸的物质的量与氢氧化钠的物质的量相等,根据N原子守恒计算反应消耗的硝酸,再根据c=$\frac{n}{V}$计算浓HNO3物质的量浓度.
解答 解:铜和一定量浓硝酸反应,Cu完全反应,反应生成气体的颜色逐渐变浅,得到的气体为NO和NO2,反应中硝酸起氧化剂与酸性作用,起酸性作用的硝酸生成Cu(NO3)2,起氧化剂作的硝酸得到NO和NO2,
根据N原子守恒,反应中作氧化剂的硝酸的物质的量=n(NO、NO2)=$\frac{1.12L}{22.4L/mol}$=0.05mol,
反应中起酸作用硝酸的物质的量=2n[Cu(NO3)2]=2n(Cu)=2×$\frac{1.92g}{64g/mol}$=0.06mol,
剩余硝酸消耗NaOH的物质的量为:1mol/L×0.01L=0.01mol,则反应后剩余硝酸的物质的量为0.01mol,
所以原浓硝酸中含有硝酸的物质的量为:0.05mol+0.06mol+0.01mol=0.12mol,
则浓HNO3物质的量浓度为:$\frac{0.12mol}{0.01L}$=12mol/l,
故选D.
点评 本题考查了化学方程式的计算、物质的量浓度的计算,题目难度中等,明确发生反应的实质为解答关键,注意掌握守恒思想在化学计算中的应用,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:实验题
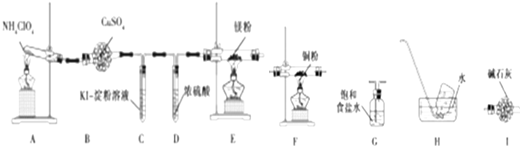
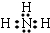 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 95℃纯水的pH<7,说明加热可导致水呈酸性 | |
| B. | pH=3的醋酸溶液,稀释至10倍后pH=4 | |
| C. | 用pH相等的盐酸、醋酸分别中和等体积等浓度的NaOH溶液,消耗两种酸的体积大小关系是:V(盐酸)>V(醋酸) | |
| D. | 室温下pH=3的醋酸溶液与pH=11的醋酸钠溶液中水电离出的C(H+)相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 光照新制的氯水时,溶液的pH逐渐减小 | |
| B. | 棕红色的NO2加压后颜色先变深后变浅(已知:2NO2 (g)?N2O4 (g)) | |
| C. | 工业上生产硫酸的过程中,使用过量的空气以提高SO2的利用率 | |
| D. | 煅烧粉碎的硫铁矿利于SO2的生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ag+、K+、NO3-、Cl - | B. | K+、Cu2+、SO42-、HCO3- | ||
| C. | Mg2+、Cl-、SO42-、Na+ | D. | CO32-、K+、NO3-、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纯铁比生铁不易生锈 | |
| B. | 当镀锡铁制品的镀层破损时,镀层仍能对铁制品起保护作用 | |
| C. | 在海轮外壳连接锌块能保护钢制外壳不受腐蚀,此方法叫做牺牲阳极的阴极保护法 | |
| D. | 电解精炼铜,阳极质量减少64g时,电子转移不一定是2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
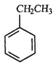 (g)+CO2(g)?
(g)+CO2(g)?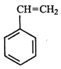 (g)=CO(g)+H2O(g)△H,其中乙苯在CO2气氛中的反应可分两步进行
(g)=CO(g)+H2O(g)△H,其中乙苯在CO2气氛中的反应可分两步进行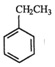 (g)?
(g)?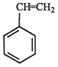 (g)+H2(g)△H1=-125KJ/mol
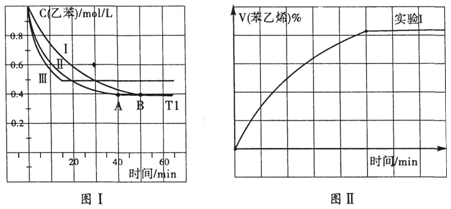
(g)+H2(g)△H1=-125KJ/mol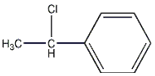 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
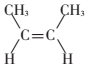 .
.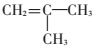 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com