
| t℃ | 700 | 800 | 830 | 1 000 | 1 200 |
| K | 1.67 | 1.11 | 1.00 | 0.60 | 0.38 |
| A. | 该反应的化学方程式是CO(g)+H2O(g)?CO2(g)+H2(g) | |
| B. | 上述反应的正反应是放热反应 | |
| C. | 若在1 L的密闭容器中通入CO2和H2各1 mol,5 min后温度升高到830℃,该反应达到平衡状态时,生成CO2为0.4 mol | |
| D. | 若平衡浓度符合关系式$\frac{c(C{O}_{2})}{3c(CO)}$=$\frac{c({H}_{2}O)}{5c({H}_{2})}$,则此时的温度为1 000℃ |
分析 A、平衡常数等于生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积,幂次方为化学方程式计量数,据此书写化学方程式;
B、平衡常数随温度升高减小,说明平衡逆向进行,逆向为吸热反应;
C、依据化学平衡三段式列式计算浓度商和平衡常数比较分析判断;
D、计算此时平衡常数结合图表数据判断.
解答 解:A、平衡常数表达式为K=$\frac{c(CO{\;}_{2}).c(H{\;}_{2})}{c(CO).c(H{\;}_{2}O)}$,化学方程式为CO+H2O=CO2+H2,故A正确;
B、平衡常数随温度升高减小,说明平衡逆向进行,逆向为吸热反应,正反应为放热反应,故B正确;
C、若在一定体积的密闭容器中通入CO2和H2各1mol,5 min后温度升高到830℃,此时测得CO2为0.4 mol时,
CO(g)+H2O(g)═CO2(g)+H2(g)
起始量(mol) 1 1 0 0
变化量(mol) 0.4 0.4 0.4 0.4
平衡量(mol) 0.6 0.6 0.4 0.4
反应前后气体物质的量不变,可以用其他物质的量代替平衡浓度计算,Q=$\frac{0.4×0.4}{0.6×0.6}$=0.4<K=1,此时平衡正向进行,故C错误;
D、若平衡浓度符合关系$\frac{c(C{O}_{2})}{3c(CO)}$=$\frac{c({H}_{2}O)}{5c({H}_{2})}$,则$\frac{c(CO{\;}_{2}).c(H{\;}_{2})}{c(CO).c(H{\;}_{2}O)}$=0.6,所以此时的温度为1000℃,故D正确;
故选C.
点评 本题考查了平衡常数书写方法,计算应用,平衡常数影响因素的分析判断,掌握基础是关键,题目难度中等.


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 实 验 | 现 象 |
| A | 加热放在坩埚中的小块钠 | 钠先熔化成光亮的小球,燃烧时,火焰为黄色,燃烧后,生成淡黄色固体 |
| B | 在酒精灯上加热铝箔 | 铝箔熔化,失去光泽,熔化的铝并不滴落,好像有一层膜兜着 |
| C | 在FeCl2溶液中滴入NaOH溶液 | 先生成白色沉淀,沉淀很快变为灰绿色,最后变为红褐色 |
| D | 在空气中久置的铝条放入NaOH溶液中 | 立刻产生大量无色气泡,铝条逐渐变细,铝条逐渐发热 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
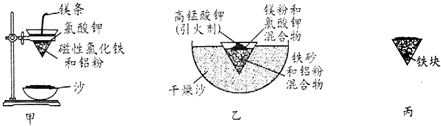
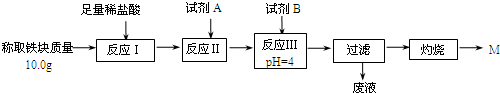
| Fe2+ | Fe3+ | Al3+ | Mg2+ | |
| 开始沉淀时的pH | 7.5 | 2.8 | 4.2 | 9.6 |
| 沉淀完全时的pH | 9.0 | 4.0 | 5 | 11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al2O3用作耐火材料、Al(OH)3用作阻燃剂 | |
| B. | 用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗下口放出 | |
| C. | 碳素钢的主要成分是铁碳合金、司母戊鼎的主要成分是铜锡合金 | |
| D. | 盛放NaOH溶液的磨口玻璃瓶要用橡胶塞 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀硫酸滴在铜片上 Cu+2H+=Cu2++H2↑ | |
| B. | 氢氧化镁与盐酸的反应 H++OH-=H2O | |
| C. | 澄清石灰水与盐酸的反应 Ca(OH)2+2H+=Ca2++2H2O | |
| D. | 碳酸钙溶于稀盐酸中 CaCO3+2H+=Ca2++H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
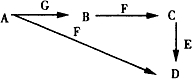 A~G为中学化学中常见的物质,B、E、F为单质,在常温下B是一种有色气体,G为黑色的固体.它们的相互转化如图所示,部分生成物未列出.试回答下列问题
A~G为中学化学中常见的物质,B、E、F为单质,在常温下B是一种有色气体,G为黑色的固体.它们的相互转化如图所示,部分生成物未列出.试回答下列问题查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com