
| A. | 碳酸钠溶液 | B. | 硫酸氢钠溶液 | C. | 硫酸钾溶液 | D. | 硝酸钠溶液 |
分析 减缓反应进行的速率,但又不影响生成氢气的总量,则降到氢离子的浓度,不改变氢离子的物质的量,以此来解答.
解答 解:A.硫酸与碳酸钠反应生成二氧化碳,生成氢气减少,故A不选;
B.硫酸氢钠溶液含氢离子,与Zn反应,则生成氢气增大,故B不选;
C.硫酸钾与Zn不反应,溶液总体积增大,则氢离子浓度减小、物质的量不变,可减缓反应进行的速率,但又不影响生成氢气的总量,故C选;
D.硝酸钠溶液在酸性条件下与Zn发生氧化还原反应生成NO,故D不选;
故选C.
点评 本题考查化学反应速率的影响因素,为高频考点,把握Zn过量、氢离子的浓度和物质的量为解答的关键,侧重分析与应用能力的考查,注意选项D为解答的易错点,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | Na2O、Na2O2组成元素相同,含有的阴、阳离子数目之比也相同 | |
| B. | 金属钠着火时,可用泡沫灭火器来灭火 | |
| C. | 钠与熔融的四氯化钛反应可制取钛 | |
| D. | 实验时用剩的钠块应该放回原试剂瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 1:3 | C. | 2:3 | D. | 3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 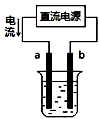 用装置精炼铜,则a极为粗铜,电解质溶液为CuSO4溶液 | |
| B. | 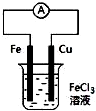 装置的总反应是:Cu+2Fe3+═Cu2++2Fe2+ | |
| C. | 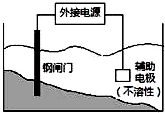 装置中钢闸门应与外接电源的负极相连 | |
| D. | 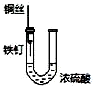 装置中的发生的是铁钉的析氢腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C12H20O6 | B. | C15H26O6 | C. | C18H32O6 | D. | C21H38O6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 每个分子中都含有氮分子 | B. | 每个分子中的氮原子个数相等 | ||
| C. | 每种物质中氮元素的质量分数相同 | D. | 都属于氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去N2中的少量O2:通过灼热的铜网,收集气体 | |
| B. | 除 CO2中的少量HCl:通入饱和Na2CO3溶液,收集气体 | |
| C. | 除去FeCl3溶液中的少量FeCl2:加入足量铁屑,充分反应后过滤 | |
| D. | 除去NaCl溶液中的少量AlCl3:加入适量氨水,过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
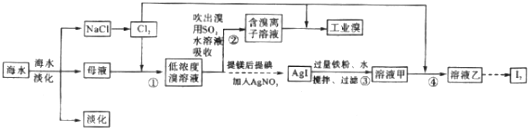
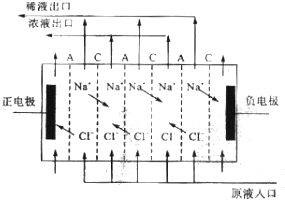
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com