
镁燃料电池在可移动电子设备电源和备用电源等方面应用前景广阔。如图为“镁一次氯酸盐”燃料电池示意图,电极为镁合金和铂合金。关于该电池的叙述正确的是
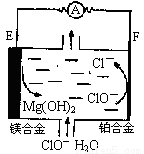
A.E为该燃料电池的正极
B.负极发生的电极反应式为ClO—+2e—+H2O=Cl—+2OH—
C.电池工作时,正极周围溶液的pH将不断变小
D.镁燃料电池负极能发生自腐蚀产生氢气,使负极利用率降低
科目:高中化学 来源:2014-2015湖北宜昌市高二3月月考化学试卷(解析版) 题型:选择题
一定条件下,分别对反应A(s)+B(g) 2C(g) (正反应吸热)进行如下操作(只改变该条件):
2C(g) (正反应吸热)进行如下操作(只改变该条件):
①增大A的用量 ②缩小容器的容积 ③升高体系温度 ④减小体系中C的量
上述措施中一定能使正反应速率加快的是
A.①③ B.②③ C.①②③ D.①②③④
查看答案和解析>>
科目:高中化学 来源:2014-2015湖北省襄阳市高二3月月考化学试卷(解析版) 题型:选择题
下列说法正确的是

A.钛和钾都采取图1的堆积方式
B.图2为金属原子在二维空间里的非密置层放置,此方式在三维空间里堆积,仅得简单立方堆积
C.图3是干冰晶体的晶胞,晶胞棱长为a cm,则在每个CO2 周围距离相等且为 的CO2有8个
的CO2有8个
D.图4这种金属晶体的晶胞,是金属原子在三维空间里以密置层采取ABCABC…堆积的结果
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省梅州市高三高三总复习质检理综化学试卷(解析版) 题型:选择题
能在水溶液中大量共存的一组离子是
A.H+、Ca2+、I-、NO3- B.Al3+、Mg2+、SO42-、CO32-
C.NH4+、Na+、Br-、SO42- D.K+、Fe2+、OH-、HCO3-
查看答案和解析>>
科目:高中化学 来源:2014-2015学年新疆乌鲁木齐地区高三第二次诊断性测试化学试卷(解析版) 题型:填空题
(10分)甲醇合成反应为:CO(g)+2H2(g)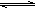 CH3OH(g)
CH3OH(g)
(1)合成甲醇的反应过程中物质能量变化如图所示。写出合成甲醇的热化学方程式 。
(2)实验室在lL密闭容器中进行模拟合成实验。将1 mol CO和2 mol H2通入容器中,分别恒温在300 ℃和500 ℃反应,每隔一定时间测得容器中甲醇的浓度如下:(表中数据单位:molL—l)
温度\时间 | 10min | 20min | 30min | 40min | 50min | 60min |
300 ℃ | 0.40 | 0.60 | 0.75 | 0.84 | 0.90 | 0.90 |
500 ℃ | 0.60 | 0.75 | 0.78 | 0.80 | 0.80 | 0.80 |
①300 ℃时反应开始10分钟内,H2的平均反应速率为 ;
②500 ℃时平衡常数K的数值为 ;
③300 ℃时,将容器的容积压缩到原来的1/2,在其他条件不变的情况下,对平衡体系产生的影响是 (选填编号)。
a.c(H2)减小
b.正反应速率加快,逆反应速率减慢
c.CH3OH的物质的量增加
d.重新平衡时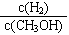 减小
减小
(3)下图是甲醇燃料电池工作的示意图,其中A、B、D均为石墨电极,C为铜电极。工作一段时间后,断开K,此时A、B两极上产生的气体体积相同。
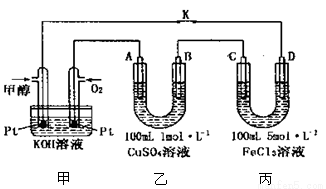
①甲中负极的电极反应式为 ;
②乙中A极析出的气体在标准状况下的体积为 ;
③反应结束后,要使丙装置中金属阳离子恰好完全沉淀,需要 mL5.0 molL—lNaOH 溶液。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年新疆乌鲁木齐地区高三第二次诊断性测试化学试卷(解析版) 题型:选择题
有机物 的一氯代物种类有(不考虑立体异构)
的一氯代物种类有(不考虑立体异构)
A.5种 B.6种 C.7种 D.8种
查看答案和解析>>
科目:高中化学 来源:2014-2015学年黑龙江省高三下学期第一次模考化学试卷(解析版) 题型:推断题
【化学—选修5:有机化学基础】(15分)有机物Ⅰ可以用E和H在一定条件下合成:请根据以下信息完成下列问题:

①A为丁醇且核磁共振氢谱有2种不同化学环境的氢;
②
③一个碳原子上连有两个羟基不稳定,易脱水形成羰基。
(1)B的分子式为: 。
(2)C→D、G→H的反应类型为 、 。
(3)芳香族化合物F的分子式为C7H8O, 苯环上的一氯代物只有两种,则F的结构简式为: 。
(4)D生成E的化学方程式为 。
E与H反应生成I的方程式为 。
(5)I的同系物K相对分子质量比I小28。K的结构中能同时满足如下条件:①苯环上只有两个取代基;②分子中不含甲基。共有 种(不考虑立体异构)。试写出上述同分异构体中任意一种消耗NaOH最多的有机物结构简式 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省郑州市高三第二次质量预测理综化学试卷(解析版) 题型:实验题
(14分)铜、铬都是用途广泛的金属。工业上利用电镀污泥(主要含有Fe2O3、CuO、Cr2O3及部分难溶杂质)回收金属铜和铬的流程如下图:

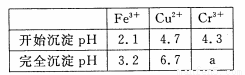
已知:部分物质沉淀的pH如下表:
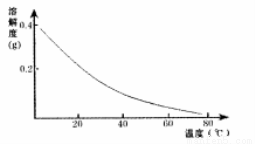
CaSO4的溶解度曲线如图:
请回答下列问题:
(1)滤液I中所含溶质主要有 (填化学式)。
(2)第②步操作中,先加人Ca(OH)2调节溶液的pH,调节范围为____,然后将浊液加热至80 ℃ 趁热过滤,所得滤渣Ⅱ的成分为 。
(3)第③步操作中,发现除了生成砖红色沉淀外,还产生了无色刺激性气味的气体。写出该步骤中发生反应的离子方程式
(4)当离子浓度≤1× 10-5mol· L-1 l时,可以认为离子沉淀完全。第④步操作中,若要使Cr3+完全沉淀,则室温下溶液中a的最小值为 。(已知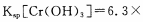
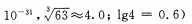
(5)Cr(OH)3受热分解为Cr2O3,用铝热法可以冶炼金属铬。写出铝热法炼铬的化学方程式
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市房山区高三一模理综化学试卷(解析版) 题型:选择题
下列物质不耐酸雨腐蚀的是
A | B | C | D |
|
|
|
|
SiO2 -光导纤维 | 聚氯乙烯 -输液管 | 酚醛树脂 -飞船仓外层 | 锰钢 -钢轨 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com