(2010?枣庄一模)卤素单质的性质活泼,卤素的化合物应用广泛,研究卤素单质及其化合物具有重要意义.
(1)氯元素的原子结构示意图为
.
(2)二氧化氯(ClO
2)是一种广泛用于水处理消毒剂,与Cl
2相比,ClO
2不但具有更显著的杀菌能力,而且不会产生对人体有害的有机氯化物.制备ClO
2的方法有以下两种:
2NaClO
3+4HCl=2ClO
2↑+Cl
2↑+2NaCl+2H
2O…①
2NaClO
2+H
2O
2+H
2SO
4=2C1O
2↑+O
2↑+Na
2SO
4+2H
2O …②
你认为哪种方法最佳
②
②
(填序号),理由是
ClO2中混有O2,不会产生对人体有害的物质
ClO2中混有O2,不会产生对人体有害的物质
.
(3)工业上用电解饱和食盐水的方法制取烧碱和氯气,请写出反应的离子方程式
.
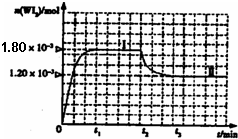
(4)碘钨灯具有比白炽灯寿命长且环保节能的特点.一定温度下,灯泡内封存的少量碘与使用过程中沉积在管壁上的钨可以发生反应:W(s)+I
2(g)
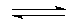
WI
2(g).为模拟上述反应,准确称取0.508g碘、0.736g金属钨置于50.0mL
的密闭容器中,加热使其反应.如图是WI
2(g)的物质的量随时间变化关系图象,其中曲线I(0~t
2时间段)的反应温度为T
1,曲线II(从t
2开始)的反应温度为T
2,且T
2>T
1.则:
①该反应的△H
小于
小于
0(填“大于”或“等于”或“小于”)
②从反应开始到t
1时间内的平均反应速率v(I
2)=
.
③下列说法中不正确的是
A
A
(填序号).
A.该反应的平衡常数表达式是
K=B.灯丝附近温度越高,灯丝附近区域WI
2越易变为W而重新沉积到灯丝上
C.利用该反应原理可以提纯钨
(5)25℃时,向5mL含有KCl和KI浓度均为0.1mol/L的混合液中,滴加6mL0.1mol/L的AgNO
3溶液,先生成的沉淀是
AgI
AgI
,溶液中离子浓度由大到小的顺序是
c(K+)>c(NO-3)>c(Cl-)>c(Ag+)>c(I-)
c(K+)>c(NO-3)>c(Cl-)>c(Ag+)>c(I-)
[不考虑H
+和OH
-.25℃时K
SP(AgCl)=1.8×10
-10、K
SP(AgI)=8.3×10
-17].
(6)Mg常用作提纯Ti的试剂,已知:
①Mg(s)+Cl
2(g)=MgCl
2(s)△H=-641kJ/mol
②Ti(s)+2Cl
2(g)=TiCl
4(l)△H=-770kJ/mol
请写出Mg与液态TiCl
4反应提纯钛的热化学方程式
2Mg(s)+TiCl4(1)=2MgCl2(s)+Ti(s)△H=-512kJ?mol-1
2Mg(s)+TiCl4(1)=2MgCl2(s)+Ti(s)△H=-512kJ?mol-1
.

 (2010?枣庄一模)卤素单质的性质活泼,卤素的化合物应用广泛,研究卤素单质及其化合物具有重要意义.
(2010?枣庄一模)卤素单质的性质活泼,卤素的化合物应用广泛,研究卤素单质及其化合物具有重要意义.

 ,故答案为:
,故答案为: ;
;
