
【题目】已知反应H2(g)+Br2(g)![]() 2HBr(g)分下列三步进行,有关键能如下表所示:
2HBr(g)分下列三步进行,有关键能如下表所示:

①Br2![]() 2Br(快反应) △H1,K1
2Br(快反应) △H1,K1
②Br+H2![]() HBr+H(慢反应) △H2,K2
HBr+H(慢反应) △H2,K2
③H+Br![]() HBr(快反应) △H3,K3
HBr(快反应) △H3,K3
则下列说法错误的是
A.△H1>△H2>△H3
B.25℃时:K1>K3
C.H2(g)+Br2(g)![]() 2HBr(g)的速率由反应②的速率决定
2HBr(g)的速率由反应②的速率决定
D.H2(g)+Br2(g)![]() 2HBr(g) △H<0
2HBr(g) △H<0
【答案】B
【解析】
A.根据所给键能计算,△H1=200kJ/mol;△H2=436-369=67 kJ/mol;△H3=-369 kJ/mol;所以△H1>△H2>△H3,故A项正确;
B.25C时,①Br2![]() 2Br是吸热反应,断键不自发进行,反应物多,③H+Br
2Br是吸热反应,断键不自发进行,反应物多,③H+Br![]() HBr是放热反应,成键能自发进行,生成物多。根据平衡常数的表达式可知K1<K2,故B项错误;
HBr是放热反应,成键能自发进行,生成物多。根据平衡常数的表达式可知K1<K2,故B项错误;
C.由①Br2![]() 2Br(快反应)△H1,K1、②Br+H2
2Br(快反应)△H1,K1、②Br+H2![]() HBr+H(慢反应)△H2,K2、③H+Br
HBr+H(慢反应)△H2,K2、③H+Br![]() HBr(快反应)△H3,K3三个反应可知,反应②最慢,是决定速率大小的反应,故C正确;
HBr(快反应)△H3,K3三个反应可知,反应②最慢,是决定速率大小的反应,故C正确;
D. H2(g)+Br2(g)![]() 2HBr(g) △H=436+200-369
2HBr(g) △H=436+200-369![]() =-102 kJ/mol<0,故D正确;
=-102 kJ/mol<0,故D正确;
故选B。


 快捷英语周周练系列答案
快捷英语周周练系列答案科目:高中化学 来源: 题型:
【题目】下列对分子性质的解释中,不正确的是
A. 水很稳定(1000℃以上才会部分分解)是因为水中含有大量的氢键
B. 乳酸有一对对映异构体,因为其分子中含有一个手性碳原子
C. 碘易溶于四氯化碳,甲烷难溶于水都可用“相似相溶”解释
D. 由右图可知酸性:H3PO4>HClO,因为H3PO4的非羟基氧原子数大于次氯酸的非羟基氧原子数 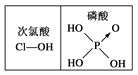
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究小组进行右图所示实验,试剂A为0.2mol/LCuSO4溶液,发现铝条表面无明显变化,于是改变实验条件,探究铝和CuSO4溶液、CuCl2溶液反应的影响因素。用不同的试剂A进行实验1~实验4,并记录实验现象:
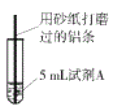
实验序号 | 试剂A | 实验现象 |
1 | 0.2mol/LCuCl2溶液 | 铝条表面有气泡产生,并有红色固体析出 |
2 | 0.2mol/LCuSO4溶液,再加入一定质量的NaCl固体 | 开始铝条表面无明显变化,加NaCl后,铝条表面有气泡产生,并有红色固体析出 |
3 | 2mol/LCuSO4溶液 | 铝条表面有少量气泡产生,并有少量红色固体 |
4 | 2mol/LCuCl2溶液 | 反应非常剧烈,有大量气泡产生,溶液变成棕褐色,有红色固体和白色固体生成 |
(1)实验1中,铝条表面析出红色固体的反应的离子方程式为_________。
(2)实验2的目的是证明铜盐中的阴离子Cl-是导致实验1中反应迅速发生的原因,实验2中加入NaCl固体的质量为______g。
(3)实验3的目的是_________ 。
(4)经检验可知,实验4中白色固体为CuCl。甲同学认为产生白色固体的原因可能是发生了Cu+CuCl2=2CuCl的反应,他设计了右图所示实验证明该反应能够发生。
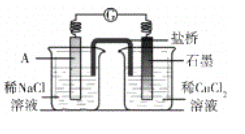
①A极的电极材料是_________。
②能证明该反应发生的实验现象是_________ 。
(5)为探究实验4中溶液呈现棕褐色的原因,分别取白色CuCl固体进行以下实验:
实验序号 | 实验操作 | 实验现象 |
i | 加入浓NaCl溶液 | 沉淀溶解,形成无色溶液 |
ii | 加入饱和AlCl3溶液 | 沉淀溶解,形成褐色溶液 |
iii | 向i所得溶液中加入2mol/LCuCl2溶液 | 溶液由无色变为褐色 |
查阅资料知:CuCl难溶于水,能溶解在Cl-浓度较大的溶液中,生成[CuCl2]
①由述球实验及资料可推断,实验4中溶液呈棕褐色的原因可能是[CuCl2]-与_____作用的结果。
②为确证实验4所得的棕褐色溶液中含有[CuCl2]-,应补充的实验是_______。
(6)上述实验说明,铝和CuSO4溶液、CuCl2溶液的反应现象与______有关。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】花椒毒素(H)有抗实验性心律失常、镇痛、抗炎等作用。由芳香族化合物A为原料合成H的一种合成路线如下:
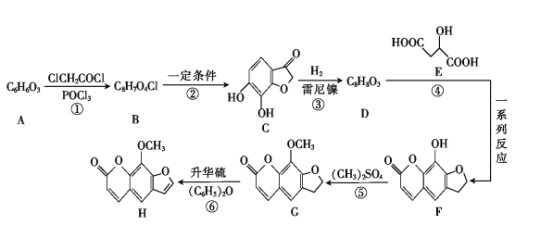
已知:![]() +ClCH2CH2Cl
+ClCH2CH2Cl![]()
![]() +HCl
+HCl
回答下列问题:
(1)A的化学名称是 _____(用系统命名法)。
(2)G中所含官能团的名称是 ____。
(3)碳原子上连有4个不同的原子或基团时,该碳称为手性碳。E中___ (填“有”或“没有”)手性碳。
(4)反应⑥的反应类型是 ____ 。
(5)D的结构简式为 _____。
(6)F与足量NaOH溶液反应的化学方程式为 ____。
(7)芳香族化合物W是D的同分异构体,能发生银镜反应和水解反应,遇FeCl3溶液发生显色反应;W的核磁共振氢谱有5组峰,且面积比为1∶2∶2∶2∶1。符合上述要求的W有____种。
(8)有机物M(![]() )是一种重要的化工原料。设计由邻苯二酚和氯乙酰氯(ClCH2COCl)为起始原料制备有机物M的合成路线____。(无机试剂及有机溶剂任用)
)是一种重要的化工原料。设计由邻苯二酚和氯乙酰氯(ClCH2COCl)为起始原料制备有机物M的合成路线____。(无机试剂及有机溶剂任用)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,其中A、C、D、E为短周期元素,最外层电子数之和为23,下列说法正确的是

A.元素A的氢化物,在同族元素中沸点最低
B.元素B的金属性比E弱
C.A、C、D均可形成18e-分子
D.与金属钠的反应中,1mol C原子和1 mol E原子得电子数目一定相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有K+、Fe2+、Ca2+、![]() 、
、![]() 、Cl-、I-中的几种离子。根据下方实验操作与现象,推测合理的是
、Cl-、I-中的几种离子。根据下方实验操作与现象,推测合理的是
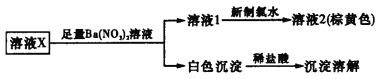
A.取溶液2,加入AgNO3溶液,可确定溶液X中是否含有Cl-
B.溶液X中一定不含Fe2+、Ca2+、![]()
C.溶液X中是否存在K+还需要通过焰色反应进一步确认
D.溶液X的溶质为K2CO3和KI
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应2SO2(g)+O2(g)![]() 2SO3(g)是硫酸工业的最重要反应,因该反应中使用催化剂而被命名为接触法制硫酸。
2SO3(g)是硫酸工业的最重要反应,因该反应中使用催化剂而被命名为接触法制硫酸。
(1)使用V2O5催化该反应时,涉及到催化剂V2O5的热化学反应有:
①V2O5(s)+SO2(g)![]() V2O4(s)+SO3(g) △H1=+59.6kJ·mol-1
V2O4(s)+SO3(g) △H1=+59.6kJ·mol-1
②2V2O4(s)+O2(g)![]() 2V2O5(s) △H2=-315.4kJ·mol-1
2V2O5(s) △H2=-315.4kJ·mol-1
则2SO2(g)+O2(g)![]() 2SO3(g) △H3=__________kJ·mol-1
2SO3(g) △H3=__________kJ·mol-1
(2)向10 L密闭容器中加入V2O4(s)、SO2(g)各1 mol及一定量的O2,改变加入O2的量,在常温下反应一段时间后,测得容器中V2O4、V2O5、SO2和SO3的量随反应前加入O2的变化如图甲所示,图中没有生成SO3的可能原因是_________________________
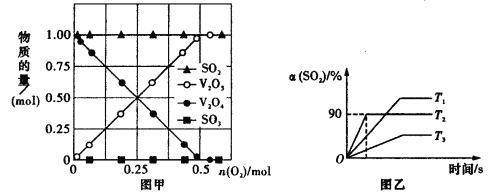
(3)在原10 L的恒容装置中,加入V2O5(s)、SO2(g)各0.6 mol,O2(g)0.3 mol,分别在T1、T2、T3时进行反应,测得容器中SO2的转化率如图乙所示。
①T2时,2SO2(g)+O2(g)![]() 2SO3(g)的平衡常数K=__________。
2SO3(g)的平衡常数K=__________。
②结合化学方程式及相关文字,解释反应为什么在T3条件下比T2条件下的速率慢:_____
(4)在温度T2使用V2O5进行反应:2SO2(g)+O2(g)![]() 2SO3(g),在保证O2(g)的浓度不变的条件下,增大容器的体积,平衡__________(填字母代号)。
2SO3(g),在保证O2(g)的浓度不变的条件下,增大容器的体积,平衡__________(填字母代号)。
A.向正反应方向移动 B.向逆反应方向移动
C.不移动 D.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配离子的稳定性可用K不稳衡量,例如Ag(NH3)2]+的K不稳=![]() 。在一定温度下,向0.1 mol/L硝酸银溶液中滴入稀氨水,发生反应Ag++2NH3[Ag(NH3)2]+]。溶液中pNH3与δ(X)的关系如图。其中pNH3=-lg[c(NH3)]、δ(X)=
。在一定温度下,向0.1 mol/L硝酸银溶液中滴入稀氨水,发生反应Ag++2NH3[Ag(NH3)2]+]。溶液中pNH3与δ(X)的关系如图。其中pNH3=-lg[c(NH3)]、δ(X)=![]() (X代表Ag+或Ag(NH3)2]+。下列说法不正确的是
(X代表Ag+或Ag(NH3)2]+。下列说法不正确的是
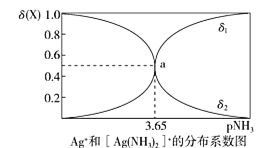
A.图中δ2代表的是δ([Ag(NH3)2]+])B.向溶液中滴入稀硝酸,δ(Ag+)减小
C.该溶液中c(NH4+)+c(H+)=c(OH-)D.该温度时,K不稳([Ag(NH3)2]+)=10-7.3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:MOH碱性比NOH强。常温下,用HCl气体分别改变浓度均为0.1mol·L-1的MOH溶液和NOH溶液的pH(溶液体积变化忽略不计),溶液中M+、N+的物质的量浓度负对数与溶液的pH关系如下图,pR=-lgc(M+)或-lgc(N+),下列说法错误的是( )
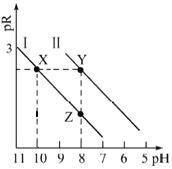
A.曲线I表示-lgc(M+)与pH关系
B.常温下,电离常数![]() =100
=100
C.溶液中水的电离程度:Y>X
D.对应溶液中c(Cl-):Y>Z
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com