
| A. | 每生成2mol SO2的同时,消耗2molSO3 | |
| B. | 混合气体的总质量不再变化 | |
| C. | 每生成2mol SO3的同时,消耗1molSO2 | |
| D. | 混合气体的压强不再变化 |
分析 根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:A、每生成2molSO2的同时,消耗2molSO3,都是指逆方向,不能说明化学反应已达反应限度,故A错误;
B、从反应开始到平衡总质量一直不变化,故B错误;
C、每生成2molSO3的同时,消耗1molSO2,都是指正方向,不能说明化学反应已达反应限度,故C错误;
D、混合气体的压强不再变化,说明正逆反应速率相等,故D正确;
故选D.
点评 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图是氯化铯晶体的晶胞,已知晶体中2个最近的Cs+离子核间距为a cm,氯化铯的摩尔质量为M,NA为阿伏加德罗常数,则氯化铯晶体的密度为( )
如图是氯化铯晶体的晶胞,已知晶体中2个最近的Cs+离子核间距为a cm,氯化铯的摩尔质量为M,NA为阿伏加德罗常数,则氯化铯晶体的密度为( )| A. | $\frac{8M}{{N}_{A}•{a}^{3}}$g.cm-3 | B. | $\frac{M{a}^{3}}{8{N}_{A}}$gcm-3 | C. | $\frac{M}{{N}_{A}•{a}^{3}}$g.cm-3 | D. | $\frac{Ma}{{N}_{A}}$g.cm |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向淀粉水解液中滴加碘水,检验淀粉是否已经水解 | |
| B. | 利用多次滴加Na2SO4溶液能够提纯蛋白质 | |
| C. | 加新制Cu(OH)2悬浊液加热,可检验糖尿病人尿液中的葡萄糖 | |
| D. | 除去甲苯中含有的少量苯酚,可加入NaOH溶液振荡后,静置分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 氮分子的电子式 N:::N | B. | 镁原子的原子结构示意图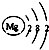 | ||
| C. | 质量数是16的氧原子 ${\;}_{8}^{16}O$ | D. | 乙醇的结构简式 C2H5OH |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
| 开始沉淀(pH) | 2.3 | 7.5 | 7.6 | 3.4 |
| 完全沉淀(pH) | 4.1 | 9.7 | 9.2 | 5.2 |
 H2O(l)═H+ (aq)+OH- (aq)△H=b kJ/mol
H2O(l)═H+ (aq)+OH- (aq)△H=b kJ/mol查看答案和解析>>
科目:高中化学 来源: 题型:解答题
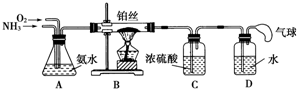
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com