
| A. | 元素种类 | B. | 原子数目 | C. | 化学键 | D. | 原子核 |
分析 物质在化学反应前后一定遵循质量守恒定律、元素守恒、原子守恒、转移电子守恒(氧化还原反应)等,化学反应的实质是有就化学键的断裂和新化学键的形成,据此分析解答.
解答 解:A.在化学反应中一定遵循元素守恒,所以反应前后元素种类不变,故A不选;
B.在化学反应前后原子数目不一定发生变化,如H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl,故B不选;
C.化学反应的实质是有就化学键的断裂和新化学键的形成,所以在化学反应中一定发生化学键的变化,故C选;
D.在化学反应中变化的是原子核外电子,原子核不发生变化,故D不选;
故选C.
点评 本题考查化学反应实质、化学变化特点等知识点,属于基础题,明确化学反应实质及反应前后变化特点是解本题关键,知道化学反应前后遵循的守恒,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
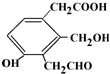 ,等物质的量的该物质,消耗Na、NaOH、NaHCO3的物质的量之比为3:2:1;消耗H2、Br2(水)的物质的量之比为2:1.
,等物质的量的该物质,消耗Na、NaOH、NaHCO3的物质的量之比为3:2:1;消耗H2、Br2(水)的物质的量之比为2:1.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
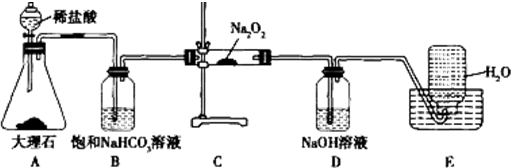
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
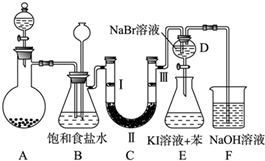
| a | b | c | d | |
| Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧气和氯气都需要先检验纯度 | B. | 都有火焰 | ||
| C. | 都放出热量 | D. | 都是氢元素化合价升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | XO${\;}_{3}^{-}$中X为+5价,故X元素位于第ⅤA族 | |
| B. | X位于第二周期第ⅦA族 | |
| C. | X一定是氯元素 | |
| D. | X可能是氮元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 形成了X3+离子和Y2-离子 | B. | 形成的化合物中含有离子键 | ||
| C. | 形成分子式为X3Y2的化合物 | D. | 形成的化合物可能具有两性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com