


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| 放电 |
| 充电 |
| 放电 |
| 充电 |
| A、锂离子电池放电时,Li+向负极迁移 |
| B、锂硫电池充电时,锂电极发生还原反应 |
| C、理论上两种电池的比能量相同 |
D、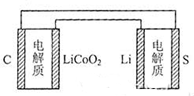 图中表示用锂离子电池给锂硫电池充电 图中表示用锂离子电池给锂硫电池充电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
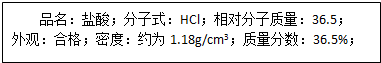
查看答案和解析>>
科目:高中化学 来源: 题型:
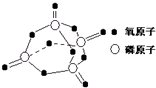 (1)用液化气的主要成分之一是丁烷,当10kg丁烷完全燃烧并生成二氧化碳和液态水时,放出热量为5×105kJ,试写出丁烷燃烧的热化学方程式
(1)用液化气的主要成分之一是丁烷,当10kg丁烷完全燃烧并生成二氧化碳和液态水时,放出热量为5×105kJ,试写出丁烷燃烧的热化学方程式| 化学键 | P-P | P-O | O=O | P=O |
| 键能/kJ?mol-1 | 197 | 360 | 499 | X |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
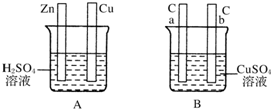 对如图中电极加以必要的连接并填空:
对如图中电极加以必要的连接并填空:查看答案和解析>>
科目:高中化学 来源: 题型:
| 配料 | 氯化钠、碘酸钾 |
| 含碘量 | 20~30mg/1Kg |
| 保质期 | 18个月 |
| 食用方法 | 勿长时间炖炒 |
| 贮藏指南 | 避热、避光、密封、防潮 |
查看答案和解析>>
科目:高中化学 来源: 题型:
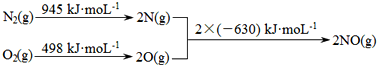
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com