
| A. | 1:4 | B. | 2:7 | C. | 1:2 | D. | 8:3 |
分析 向H2SO4、CuSO4混和溶液中投入足量的铁粉,发生反应Fe+CuSO4=Cu+FeSO4,Fe+H2SO4=FeSO4+H2↑,最后残留固体的质量与加入的铁粉的质量相等,则反应Fe+CuSO4=Cu+FeSO4导致固体增重等于反应Fe+H2SO4=FeSO4+H2↑中参加反应的Fe的质量,假定反应Fe+H2SO4=FeSO4+H2↑中参加反应的Fe的质量为56g,计算H2SO4的物质的量,根据差量法计算CuSO4的物质的量,据此计算原溶液中c(H+)与c(SO42-)之比.
解答 解:最后残留固体的质量与加入的铁粉的质量相等,则反应Fe+CuSO4=Cu+FeSO4导致固体增重等于反应Fe+H2SO4=FeSO4+H2↑中参加反应的Fe的质量,
假定反应Fe+H2SO4=FeSO4+H2↑中参加反应的Fe的质量为56g,其物质的量为1mol,由方程式可知n(H2SO4)=n(Fe)=1mol,
Fe+CuSO4=Cu+FeSO4 固体增重△m
1mol 64g-56g=8g
n(CuSO4) 56g
故n(CuSO4)=$\frac{56g}{8g}$×1mol=7mol,
故原溶液中c(H+):c(SO42-)=1mol×2:(1mol+7mol)=1:4,
故选:A.
点评 本题考查混合物的有关计算,难度中等,注意差量法与特殊值法的应用,关键是分析反应Fe+CuSO4=Cu+FeSO4 导致固体增重等于反应Fe+H2SO4=FeSO4+H2↑中参加反应的Fe的质量.


科目:高中化学 来源: 题型:选择题
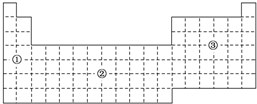 如果把元素周期表分为下面3个区域,则最活泼的金属、最活泼的非金属、最不活泼的非金属元素分别位于( )
如果把元素周期表分为下面3个区域,则最活泼的金属、最活泼的非金属、最不活泼的非金属元素分别位于( )| A. | ①区、③区、③区 | B. | ①区、③区、②区 | C. | ①区、②区、②区 | D. | ②区、③区、③区 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
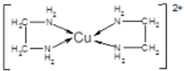
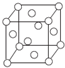
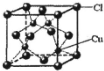 ,其中Cl-的配位数为4,已知晶胞的棱长为dcm,用NA表示阿伏加德罗常数值,则晶胞的密度表达式为$\frac{396}{{d}^{3}•{N}_{A}}$g/cm3.
,其中Cl-的配位数为4,已知晶胞的棱长为dcm,用NA表示阿伏加德罗常数值,则晶胞的密度表达式为$\frac{396}{{d}^{3}•{N}_{A}}$g/cm3.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
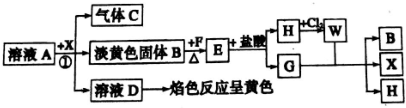
 ,G中化学键的类型为极性共价键;
,G中化学键的类型为极性共价键;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 近年来,我国北方地区雾霾频发.引起雾霾的PM2.5微细粒子包含(NH4)2SO4、NH4NO3、有机颗粒物及扬尘等,通过测定雾霾中锌等重金属的含量,可知交通污染是目前造成雾霜天气的主要原因之一.冋答下列问题:
近年来,我国北方地区雾霾频发.引起雾霾的PM2.5微细粒子包含(NH4)2SO4、NH4NO3、有机颗粒物及扬尘等,通过测定雾霾中锌等重金属的含量,可知交通污染是目前造成雾霜天气的主要原因之一.冋答下列问题: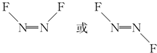 ,1mol N2F2分子中所含有σ键的数目是3NA(填字母)
,1mol N2F2分子中所含有σ键的数目是3NA(填字母)查看答案和解析>>
科目:高中化学 来源: 题型:填空题
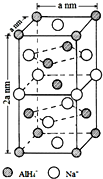
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na通常保存在煤油中,而同族的Li只能保存在液体石蜡中 | |
| B. | 金刚石与石墨互为同素异形体,已知 燃烧热金刚石更高,则石墨比金刚石更稳定 | |
| C. | X的化学式为Na2CO3,若Mg 与CO2则生成MgO和C | |
| D. | 当有0.4molNa参与反应时,被氧化的CO2为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在一定温度下,1L的密闭容器内某一反应M、N的物质的量随反应时间变化的曲线如图所示,下列表述中正确的是( )
在一定温度下,1L的密闭容器内某一反应M、N的物质的量随反应时间变化的曲线如图所示,下列表述中正确的是( )| A. | t1时,N的浓度是M的浓度的2倍 | |
| B. | t2时,正逆反应速率相等,反应达到平衡 | |
| C. | t3时,正反应速率大于逆反应速率 | |
| D. | 反应的化学方程式为:M?2N |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com