
有五种原子序数在36以内的元素A、B、C、D、E,它们的原子序数依次增大,A原子的最外层电子数等于其电子层数,A、B、C原子核外电子层数之和是6,C原子的电子数为A和B两元素原子电子总数的两倍;D和C的最高价氧化物对应水化物的酸性前者强于后者;E可和C形成原子个数比为1:1和1:2的两种化合物,其中一种物质是工业合成硫酸的常见原料,这两种化合物的摩尔质量相差32。试回答下列问题:
(1)E在周期表中的位置是 ,基态B原子的价电子排布式 。
(2)写出CD2的电子式 ,根据价层电子对互斥(VSEPR)理论推测,CD2分子的空间构型为 ,该分子是 分子(填“极性”或“非极性”)。
(3)通常情况下,AB3为无色有刺激性气味的液体,沸点303.8K,熔点193K。AB3固态时的晶体类型为 ;其水溶液有弱酸性,它的电离方程式为 。
(4)下列性质可作为比较C、D两元素非金属性强弱依据的是 (填编号)。
①C、D的最高价氧化物对应水化物的酸性强弱
②C、D的气态氢化物的水溶液的酸性强弱
③C、D的气态氢化物的稳定性强弱
④C、D的简单离子是否易被E3+氧化
⑤相同条件下,C、D的钠盐溶液的碱性强弱
(1)第四周期 Ⅷ族;2S22P3;
(2) ; V型;极性分子;
; V型;极性分子;
(3)分子晶体;HN3  H++N3--;
H++N3--;
(4)①③④
解析试题分析:
(1)A原子的最外层电子数等于其电子层数,又是原子序数最小的所以为氢元素,E可和C形成原子个数比为1:1和1:2的两种化合物,其中一种物质是工业合成硫酸的常见原料,而且两种化合物的摩尔质量相差32,可以推断其中一种为FeS2,另一种为FeS,则E为铁元素,C为硫元素,又根据A、B、C原子核外电子层数之和是6,C原子的电子数为A和B两元素原子电子总数的两倍;推断出B为氮元素;
(2) SCl2分子中中心原子S的价层电子对数为4,孤电子对数为2,所以分子空间构型为V型;
分子不是中心对称分子,所以为极性分子;
(3)溶沸点低,分子间的作用力为范德华力,所以为分子晶体;
(4)元素非金属性强弱判断依据有:
最高价氧化物对应水化物的酸性强则元素非金属性强
元素的气态氢化物越稳定性则元素非金属性强
简单阴离子还原性越强则元素非金属性越弱
所以选①③④
考点:本题以元素推断为基础,考查元素周期表、 电子排布式、、晶体类型、分子的空间构型及极性等知识。


科目:高中化学 来源: 题型:单选题
下列说法正确的是
| A.天然油脂的分子中含有酯基,属于酯类 |
| B.煤经处理变为气体燃料的过程属于物理变化 |
| C.A12O3可以与水反应得到其对应水化物 Al(OH)3 |
| D.可以用加热使蛋白质变性的方法分离提纯蛋白质 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
【化学选修2:化学与技术】(15分)工业上生产高氯酸时,还同时生产了一种常见的重要含氯消毒剂和漂白剂亚氯酸钠(NaClO2),其工艺流程如下:
已知:①NaHSO4溶解度随温度的升高而增大,适当 条件下可结晶析出。
②高氯酸是至今为止人们已知酸中的最强酸,沸点90 ℃。
请回答下列问题:
反应器Ⅰ中发生反应的化学方程式为 ,冷却的目的是 ,能用蒸馏法分离出高氯酸的原因是 。
(2)反应器Ⅱ中发生反应的离子方程式为 。
(3)通入反应器Ⅱ中的SO2用H2O2代替同样能生成NaClO2,请简要说明双氧水在反应中能代替SO2的原因是 。
(4)Ca(ClO)2、ClO2、NaClO2等含氯化合物都是常用的消毒剂和漂白剂,是因为它们都具有 ,请写出工业上用氯气和NaOH溶液生产消毒剂NaClO的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
A、B、C、D、E、F为前四周期的元素。其中,A元素和B元素的原子都有一个未成对电子,A3+比B-少一个电子层,B原子得一个电子后3p轨道全充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解性在同族元素所形成的氢化物中最大;D的最高化合价与最低化合价代数和为4,其最高价氧化物对应的水化物可以用于制取炸药和制作铅蓄电池;E元素的基态原子核外有六种运动状态的电子;F元素的单质为紫红色固体,可通过“湿法冶金”而得。请回答下列问题:
(1)CB3分子中心原子的杂化类型是 。
(2)F元素的原子的外围电子排布式为 ;如图所示为F与Au以3∶1形成的合金晶胞图,在图中的括号内写出对应的元素符号。
(3)B、D元素最高价氧化物对应的水化物的酸性强弱: > (填化学式)。
(4)用导线将A和F的单质做成的电极连接起来,插入到盛有C的最高价氧化物的水化物的浓溶液中构成原电池,试写出在单质A表面发生反应的电极反应式:_____。
(5)分子R是由C元素与氢元素形成的18电子分子,R的电子式为 。
(6)24 g E的单质在33.6 L氧气(标准状况)中燃烧,至反应物全部耗尽,放出x kJ热量。则1mol E与O2反应生成E的低价氧化物时的热化学方程式为 (已知:E的燃烧热为y kJ/mol)。
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
X、Y、Z、W、Q五种元素原子序数依次增大,X为地壳中含量最高的元素,在周期表中Y与X、Z、Q相邻,Q与X最高能层上的电子数相同,W原子核外有七种不同能级的电子,且最高能级上没有未成对电子,W与X可形成W2X和WX两种化合物。
回答下列问题:
(1)X能与原子序数最小的元素形成原子个数比为1:1的分子,该分子的电子式为 。
(2)W2+的核外电子排布式为 。
(3)Z单质能溶于水,水液呈 色,在其中通人Y的某种氧化物,溶液颜色褪去,用化学方程式表示原因 。
(4)Y、Z元素的第一电离能Y Z(填“>”、“<”或“=”)。 X与地壳中含量第二的元素形成的化合物所属的晶体类型为 。
(5)已知X分别与元素碳、氮形成化合物有如下反应:
2CX(g)+X2(g)=2CX2(g) △H=—566.0kJ·mol-1
N2(g)+X2(g)="2NX(g)" △H=189.5kJ·mol-1
2NX(g)+X2(g)=2NX2(g) △H=—112.97kJ·mol-1
写出NX2与CX反应生成大气中存在的两种气态物质的热化学方程式: 。
(6)Y与磷原子形成P4Y3分子,该分子中没有π键,且各原子最外层均已达8电子结构,则一个P4Y3分子中含有的极性键和非极性键的个数分别为 个、 个。
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
(15分)(1)A、B、C、D、E、F六种物质在一定条件下有如图所示的转化关系,所有反应物和生成物均已给出。
①若反应①②③均为水溶液中的置换反应,A、D、E都为卤素单质,化合物中的阳离了均为Na+,则A、D、E的氧化性由弱到强的顺序为 (写化学式)。在一定条件下E和D以物质的量比为5:l在硫酸溶液中恰好完全反应,写出该反应的离子方程式: 。
②若把B、C、F三种溶液汇集在一起得到1L混合溶液,并物质的转化关系给其中加入一定量的E,溶液中卤素阴离子的物质的量与通入E的体积(标准状况)的关系如下表所示(x和y均大于0)。
各离子的量与E的体积的关系
I.当通入E的体积为2.8L时,溶液中发生反应的离子方程式为 。
II.x= ,y= (填具体数据)。
III.当通入E的体积为11.2L时,该溶液中c(Na+)=____ mol·L-1(通入E后溶液的体积变化忽略不计)。
(2)用H2O2可除去工业尾气中的Cl2,相关反应:
H2O2(1)+Cl2(g) 2HCl(g)+O2(g)△H>0.
2HCl(g)+O2(g)△H>0.
①为了提高H2O2的除氯效果,采取的措施最好的是 (只改变一种条件),其原因是: 。
(g)+ O2(g)= H2O(1), △H2 = -285.84kJ·mol-l
O2(g)= H2O(1), △H2 = -285.84kJ·mol-l
Cl2(g)+ H2(g)= 2HCl(g), △H3 = -184.6kJ·mol-l
则H2O2(1)与Cl2(g)反应生成HCl(g)和O2(g)的热化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
苯巴比妥是安眠药的成分,化学式为C12H12N2O3,分子结构中有两个六元环:下图是以A为原料合成苯巴比妥的流程示意图。完成下列填空。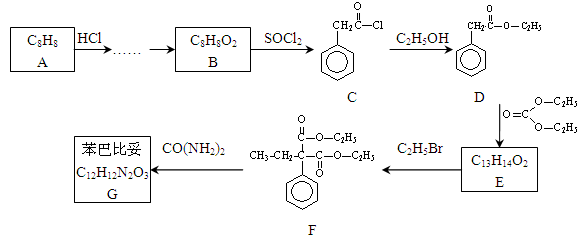
已知:①有机物D、E中亚甲基(—CH2—)的氢原子受羰基影响活性较高,容易发生如下反应:
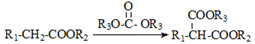
②
(1)芳香烃A与HCl反应后,制取B还需进行反应的类型依次为 。
(2)一种酯与B互为同分异构体,且苯环上只有一个取代基,该酯同分异构体
有 种,写出其中一种结构的系统命名 。
(3)写出D 转化为E的化学方程式:
(4)苯巴比妥G的结构简式:
(5)E与CO(NH2)2在一定条件下合成的高分子结构简式:
(6)已知: ,请设计合理方案以B的同系物
,请设计合理方案以B的同系物 为原料
为原料
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
(15 分)
“心得安”是治疗心脏病的药物,下面是它的一种合成路线(具体反应条件和部分试剂略):
回答下列问题:
(1)试剂a是 ,试剂b的结构简式为 ,b中官能团的名称是 。
(2)③的反应类型是 。
(3)心得安的分子式为 。
(4)试剂b可由丙烷经三步反应合成:
反应1的试剂与条件为 ,
反应2的化学方程式为 ,
反应3的反应类型是 。(其他合理答案也给分)
(5)芳香化合物D是1-萘酚的同分异构体,其分子中有两个官能团,能发生银镜反应,D能被KMnO4酸性溶液氧化成E( C2H4O2) 和芳香化合物F (C8H6O4),E和F与碳酸氢钠溶液反应均能放出CO2气体,F芳环上的一硝化产物只有一种。D的结构简式为 ;
由F生成一硝化产物的化学方程式为 ,
该产物的名称是 。
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
醋柳酯是一种镇咳祛痰药,用于上呼吸道感染、感冒咳嗽、急慢性支气管炎症等的治疗,醋柳酯可由下图所示路线合成:
(1)A的含氧官能团名称为 ;中间产品C中混有反应物A和B,检验C中含有A的试剂是 。
(2)由C制醋柳酯的反应类型为 ;写出C和足量NaOH溶液反应的化学方程式 。
(3)A的同分异构体很多,写出两种属于酯类、且能与FeCl3溶液反应显紫色的同分异构体的结构简式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com