
下列说法中正确的是
A.酸根离子中不可能含有金属元素
B.酸性氧化物在一定条件下,都可以与碱反应生成盐和水
C.一种元素可能有多种氧化物,但是同种化合价只对应一种氧化物
D.还原产物只有还原性,氧化产物只有氧化性
科目:高中化学 来源:2016届山东省邹城市高三上学期10月月考化学试卷(解析版) 题型:选择题
下列离子方程式的书写及评价均合理的是
选项 | 离子方程式 | 评价 |
A | 将1 mol Cl2通入含1 mol FeI2的溶液中:2Fe2++2I-+2Cl2=2Fe3++4Cl-+I2 | 正确;Cl2过量,可将Fe2+、I-均氧化 |
B | Mg(HCO3)2溶液与足量的NaOH溶液反应:Mg2++HCO3-+OH-=MgCO3↓+H2O | 正确;酸式盐与碱反应生成正盐和水 |
C | 过量SO2通入NaClO溶液中:SO2+H2O+ClO-=HClO+HSO3- | 正确;说明酸性:H2SO3强于HClO |
D | 1 mol·L-1的NaAlO2溶液和2.5 mol·L-1的HCl溶液等体积互相均匀混合:2AlO2-+5H++4H2O=Al3++Al(OH)3↓+5H2O | 正确;AlO2-与Al(OH)3消耗的H+的物质的量之比为2∶3[ |
查看答案和解析>>
科目:高中化学 来源:2016届湖南省益阳市高三上学期第二次模拟测试化学试卷(解析版) 题型:选择题
有Al、CuO、Fe2O3组成的混合物共10.0 g,放入500 mL某浓度的盐酸中,混合物完全溶解,当再加入250 mL 2.00 mol·L-1的NaOH溶液时,得到沉淀最多。上述盐酸的浓度为
A.1.00 mol·L-1 B.0.500 mol·L-1 C.2.00 mol·L-1 D.3.00 mol·L-1
查看答案和解析>>
科目:高中化学 来源:2016届重庆市高三上学期10月月考理综化学试卷(解析版) 题型:推断题
(本部选作)(15分)化合物F是一种抗心肌缺血药物的中间体,可以通过以下方法合成:
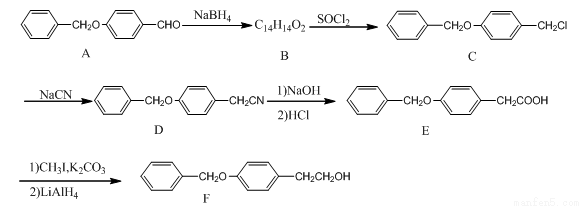
(1)化合物C中的官能团为______________和________________(填官能团的名称)。
(2)化合物B的结构简式为_____________;由A→B的反应类型是:____________。
(3)同时满足下列条件的A的同分异构体有______________种。试写出一种分子中只含有6种等效氢的结构简式:_____________________。
①分子含有2个独立苯环,无其他环状结构
②能发生银镜反应和水解反应
③不能和FeCl3发生显色反应,但水解产物可以,分子中含有甲基
(4)(4)已知: ,请写出以
,请写出以 为原料制备化合物X(
为原料制备化合物X(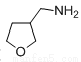 )(结构简式见右图)的合成路线流程图(无机试剂可任选)。合成路线流程图示例如下:____________________
)(结构简式见右图)的合成路线流程图(无机试剂可任选)。合成路线流程图示例如下:____________________
查看答案和解析>>
科目:高中化学 来源:2016届浙江省瑞安市四校高三上学期第一次联考化学试卷(解析版) 题型:选择题
某混合溶液中可能含有下列离子中的若干种:NH4+、Na+、Al3+、Fe2+、Fe3+、AlO2-、SO42-、I-、NO3-、CO32-,已知各离子的浓度均约为0.1mol/L,现取两份20mL该溶液进行如下实验:
第一份加入足量盐酸,产生气体在空气中变为红棕色,在反应后的溶液中加入BaCl2溶液,有白色沉淀产生。第二份逐滴滴加NaOH溶液至过量,产生沉淀但不溶解,同时逸出气体。根据上述实验情况,以下说法错误的是
A.该混合溶液中一定不含有Fe3+、AlO2-、Al3+、CO32-
B.该混合溶液通过继续进行焰色反应可以间接确定是否含有I-
C.该混合溶液中肯定含有Fe2+、NH4+、SO42-、NO3-
D.向该混合溶液中滴加酚酞试液后呈红色
查看答案和解析>>
科目:高中化学 来源:2016届浙江省高三上学期第一次月考化学试卷(解析版) 题型:选择题
下列各项操作中,不发生“先产生沉淀,然后沉淀又溶解”现象的是
①向饱和碳酸钠溶液中通入过量CO2
②向NaAlO2溶液中逐滴加入过量的稀盐酸
③向AlCl3溶液中逐滴加入过量稀NaOH溶液
④向硅酸钠溶液中逐滴加入过量的盐酸
⑤向AgNO3溶液中逐滴加入稀氨水
A.①② B.②③ C.①④ D.④⑤
查看答案和解析>>
科目:高中化学 来源:2016届四川省高三上学期第一次月考化学试卷(解析版) 题型:选择题
下列有关实验说法不正确的是
A.硅酸钠溶液应保存在带橡皮塞的试剂瓶中
B.NaCl溶液蒸发结晶时,蒸发皿中有晶体析出并剩余少量液体即停止加热
C.液溴易挥发,在存放液溴的试剂瓶中应加水液封
D.沸水中滴加适量饱和FeCl3溶液,形成带电的胶体,导电能力增强
查看答案和解析>>
科目:高中化学 来源:2016届安徽省皖南八校高三上学期第一次联考化学试卷(解析版) 题型:填空题
硒鼓回收料含硒约97%,其余为约3%的碲和微量的氯。从该回收料中回收硒的工艺流程如下图所示(已知煅烧过程中,回收料中的硒、碲被氧化成SeO2和TeO2):

部分物质的物理性质如下表:

回答下列问题:
(1)Se与S是同族元素,比S多1个电子层,Se在元素周期表的位置为第 周期,第 族;H2 SeO4的酸性比H2SO4的酸性 (填“强”或“弱”)。
(2)实验中往往需将硒鼓回收料粉碎,其目的是
(3)乙醇浸取后过滤所得滤渣的主要成分是_____________。蒸发除去溶剂后,所得固体中仍含有少量TeO2杂质,除杂时适宜采用的方法是______________________。
(4)以SO2为还原剂可将SeO2还原为单质硒,写出反应的化学方程式:________________________
查看答案和解析>>
科目:高中化学 来源:2016届甘肃省高三上学期第一次月考化学试卷(解析版) 题型:选择题
利用下列实验装置进行的相应实验,不能达到实验目的的是
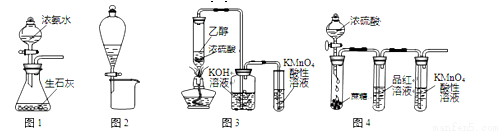
A.用图1所示装置可制取氨气
B.用图2所示装置可分离CH3CH2OH和CH3COOC2H5混合液
C.用图3所示装置可制取乙烯并验证其易被氧化
D.用图4所示装置可说明浓H2SO4具有脱水性、强氧化性,SO2具有漂白性、还原性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com