
| A. | 浓氨水 | B. | NaOH溶液 | C. | 盐酸 | D. | CO2和水 |
 一线名师提优试卷系列答案
一线名师提优试卷系列答案科目:高中化学 来源: 题型:多选题
| A. | 烷烃的同系物可用通式CnH2n+2表示 | |
| B. | 同系物的化学性质相似 | |
| C. | 同系物的物理性质相同 | |
| D. | 同分异构体的化学性质一定不相似 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学性质 | 实际应用 | |
| A | 铁粉具有还原性 | 袋装食品的抗氧剂 |
| B | 铁离子的氧化性比铜离子强 | FeCl3溶液腐蚀Cu刻制印刷电路板 |
| C | Na2O2能与CO2反应生成氧气 | 呼吸面具中的氧气来源 |
| D | SO2具有漂白性 | 豆芽菜、银耳等食品的漂白 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
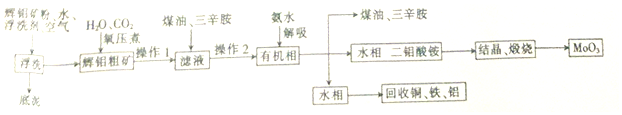
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 保护钢铁水闸门可用外接电源阳极保护法 | |
| B. | 反应NH3(g)+HI(g)═NH4I(s)在低温下可自发进行,则△H>0,△S>0 | |
| C. | 常温下,向0.lmol•L-1CH3COONa溶液中滴加盐酸,溶液中水的电离程度增大 | |
| D. | 恒温下进行的反应2NO2(g)?N2O4(g)达平衡时,缩小容器体积再达平衡时,气体 的颜色比第一次平衡时的深 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
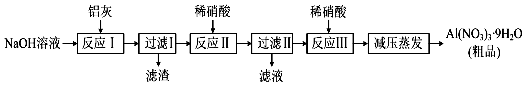
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
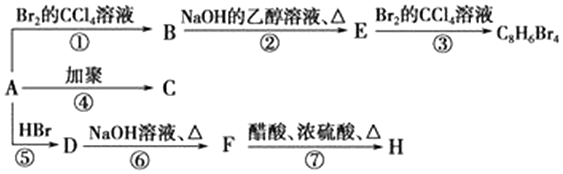
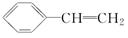 .
.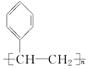 ,D
,D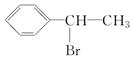 ,E
,E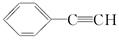 ,H
,H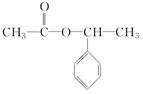 .
. +NaOH$→_{△}^{水}$
+NaOH$→_{△}^{水}$ +NaBr.写出⑦反应的化学方程式
+NaBr.写出⑦反应的化学方程式 +CH3COOH$→_{△}^{浓硫酸}$
+CH3COOH$→_{△}^{浓硫酸}$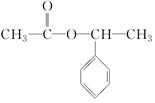 +H2O.
+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
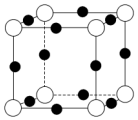 已知:A、B、C、D、E、F五种元素核电荷数依次增大,属周期表中前四周期的元素.其中A原子核外有三个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的熔点在同周期元素形成的单质中是最高的;F原子核外最外层电子数与B相同,其余各层均充满.请根据以上信息,回答下列问题:
已知:A、B、C、D、E、F五种元素核电荷数依次增大,属周期表中前四周期的元素.其中A原子核外有三个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的熔点在同周期元素形成的单质中是最高的;F原子核外最外层电子数与B相同,其余各层均充满.请根据以上信息,回答下列问题: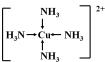 (用箭头表示出提供孤对电子的原子).将 F 单质的粉末加入A的气态氢化物的水化物浓溶液中,通入 O2,充分反应后溶液呈深蓝色,该反应的离子方程式为2Cu+8NH3•H2O+O2=2[Cu(NH3)4]2++4OH-+6H2O.
(用箭头表示出提供孤对电子的原子).将 F 单质的粉末加入A的气态氢化物的水化物浓溶液中,通入 O2,充分反应后溶液呈深蓝色,该反应的离子方程式为2Cu+8NH3•H2O+O2=2[Cu(NH3)4]2++4OH-+6H2O.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com