
2NaI+MnO2+3H2SO4![]() 2NaHSO4+MnSO4+2H2O+I2(1)
2NaHSO4+MnSO4+2H2O+I2(1)
2NaIO3+5NaHSO3![]() 2Na2SO4+3NaHSO4+H2O+I2(2)
2Na2SO4+3NaHSO4+H2O+I2(2)
下列说法正确的是
A.两个反应中NaHSO4均为氧化产物
B.I2在反应(1)中是还原产物,在反应(2)中是氧化产物
C.氧化性:MnO2>![]() >
>![]() >I2
>I2
D.反应(1)(2)中生成等量的I2时转移电子数比为1∶5
科目:高中化学 来源: 题型:阅读理解
 PCl3(气)+Cl2(气);△H>0 K=1 ①
PCl3(气)+Cl2(气);△H>0 K=1 ① COCl2(气);△H<0 K=5×104 ②
COCl2(气);△H<0 K=5×104 ② CO(气)+Cl2(气);△H>0③
CO(气)+Cl2(气);△H>0③ CO2(g)+H2(g);△H.得到以下三组数据,据此回答下列问题:
CO2(g)+H2(g);△H.得到以下三组数据,据此回答下列问题:| 实验组 | 温度 | 起始量 | 平衡量 | 达到平衡所需时间 | ||
| H2O | CO | H2 | CO2 | |||
| 1 | 650℃ | 1mol | 2mol | 0.8mol | 0.8mol | 5min |
| 2 | 900℃ | 0.5mol | 1mol | 0.2mol | 0.2mol | 3min |
| 3 | 900℃ | a mol | b mol | c mol | d mol | t |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
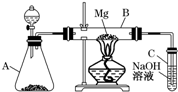 某同学用如图所示装置探究SO2的性质及其有关实验.
某同学用如图所示装置探究SO2的性质及其有关实验.查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
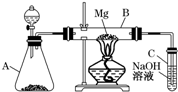
查看答案和解析>>
科目:高中化学 来源:2010-2011学年湖北省黄石二中高一(上)期末化学模拟试卷(解析版) 题型:解答题
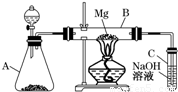
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com