
| t/min | 2 | 4 | 7 | 9 |
| n��Y��/mol | 0.12 | 0.11 | 0.10 | 0.10 |
| A�� | ��Ӧǰ2 min��ƽ������v��Z��=2.0��10-3 mol•L-1•min-1 | |
| B�� | �����������䣬�����¶ȣ���Ӧ�ﵽ��ƽ��ǰ��v���棩��v������ | |
| C�� | ���������������䣬��ʼʱ�������г���0.32 mol����X��0.32 mol ����Y������ƽ��ʱ��c��Z��=0.24 mol•L-1 | |
| D�� | ���¶��´˷�Ӧ��ƽ�ⳣ����K=1.44 |
���� A�����v=$\frac{��c}{��t}$������֮�ȵ��ڻ�ѧ������֮�ȼ��㣻
B����H��0��Ϊ���ȷ�Ӧ�������¶ȣ�ƽ�������ƶ���
C���¶ȡ�������䣬��ʼʱ�������г���0.32 mol����X��0.32 mol ����Y������ƽ��ʱ�����ʵ�����Ũ�ȳ����ȣ�
D��X��g��+Y��g��?2Z��g��
��ʼ 0.016 0.016 0
ת�� 0.006 0.006 0.012
ƽ�� 0.01 0.01 0.012
K=$\frac{0.01{2}^{2}}{0.01��0.01}$���Դ������
��� �⣺A����Ӧǰ2 min��ƽ������v��Z��=$\frac{\frac{0.16mol-0.12mol}{10L}}{2min}$��2=4.0��10-3 mol•L-1•min-1����A����
B����H��0��Ϊ���ȷ�Ӧ�������¶ȣ�ƽ�������ƶ�����v���棩��v����������B����
C���¶ȡ�������䣬��ʼʱ�������г���0.32 mol����X��0.32 mol ����Y������ƽ��ʱ�����ʵ�����Ũ�ȳ����ȣ�ԭƽ��Z��Ũ��Ϊ0.012mol/L����ƽ���c��Z��=0.024 mol•L-1����C����
D��X��g��+Y��g��?2Z��g��
��ʼ 0.016 0.016 0
ת�� 0.006 0.006 0.012
ƽ�� 0.01 0.01 0.012
K=$\frac{0.01{2}^{2}}{0.01��0.01}$=1.44����D��ȷ��
��ѡD��
���� ���⿼�黯ѧƽ��ļ��㣬Ϊ��Ƶ���㣬���ձ��������ݣ�K�����ʵļ���Ϊ���Ĺؼ������ط�������������Ŀ��飬ע��ѡ��C��ƽ�ⲻ�ƶ���Ũ��Ϊ2����ϵ����Ŀ�ѶȲ���


 �������ϵ�д�
�������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢ۢܢݢ� | B�� | �ڢܢݢ� | C�� | �ܢ� | D�� | �٢ݢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
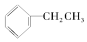 ��CH3COOCH3 ��
��CH3COOCH3 ��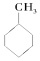
| A�� | �ڢۢ� | B�� | �٢ݢ� | C�� | �٢ܢ� | D�� | �٢ܢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
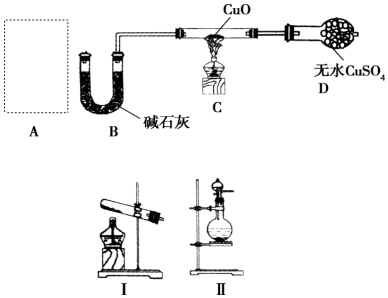
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����¶ȣ�����Ӱٷ������������淴Ӧ���ʶ��ӿ� | |
| B�� | ʹ�ô���������Ӱٷ������������淴Ӧ���ʶ��ӿ� | |
| C�� | ʹ�ô������Խ��ͷ�Ӧ�Ļ�� | |
| D�� | �����¶ȣ�������Ӧ��ƽ�ⳣ�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��NaHCO3��Һ�м����������ʯ��ˮ | |
| B�� | ������������Һ�м����Ƶ��� | |
| C�� | ���Ȼ�����Һ��ͨ������SO2 | |
| D�� | ��̼������Һ��ͨ�����CO2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com