
����Ŀ��NaCN(�軯��)��һ����Ҫ�Ļ�������ԭ��,�����ڵ�ơ�ұ����л��ϳɵȡ��ش��������⡣
��1��NaCN��Һ�з���ˮ�ⷴӦ�����ӷ���ʽΪ_______________________________,ʵ��������NaCN��Һ�ķ�����______________________________��
��2��NaCN��Cl2��Ӧ���Ʊ�ClCN(����)������ĵ���ʽΪ_________��
��3���Ʊ�NaCN�ķ����ܶ��֡�
�ٰ��Ʒ�����Ӧԭ��Ϊ2Na+2C+2NH3![]() 2NaCN+3H2���÷�Ӧ��,ÿ����1molNaCN,ת�Ƶ��ӵ����ʵ���Ϊ_________��
2NaCN+3H2���÷�Ӧ��,ÿ����1molNaCN,ת�Ƶ��ӵ����ʵ���Ϊ_________��
��NaCNҲ����HCN ��NaOH��Ӧ�Ƶá�
��֪��CH4(g)=C(s)+2H2(g) ��H1��
2HCN(g)=2C(s)+H2(g)+N2(g) ��H2;
N2(g)+3H2(g)![]() 2NH3(g) ��H3��
2NH3(g) ��H3��
��Ӧ��CH4(g)+NH3(g)![]() HCN(g)+3H2(g)�ġ�H=____________(�ú���H1����H2����H3�Ĵ���ʽ��ʾ)��
HCN(g)+3H2(g)�ġ�H=____________(�ú���H1����H2����H3�Ĵ���ʽ��ʾ)��
���𰸡� CN-+H2O![]() HCN+OH- ��NaCN�ܽ��ڽ�Ũ��NaOH��Һ��,Ȼ���ټ�ˮϡ��
HCN+OH- ��NaCN�ܽ��ڽ�Ũ��NaOH��Һ��,Ȼ���ټ�ˮϡ�� ![]() 3mol
3mol ![]()
����������1�����⿼������ˮ�ⷽ��ʽ����д����ˮ�����ʵ����ƣ�NaCN����ǿ�������Σ�CN������ˮ�⣬��ˮ������ӷ���ʽΪCN����H2O![]() HCN��OH��������NaCN��Һʱ��Ϊ����CN��ˮ�⣬��Ҫ��NaCN�ܽ��ڽ�Ũ��NaOH��Һ�У�Ȼ���ˮϡ�ͣ���2�����⿼�����ʽ����д��ClCN�ĵ���ʽ������HCN��HCN�ĵ���ʽΪH��CN����ClCN�ĵ���ʽΪ
HCN��OH��������NaCN��Һʱ��Ϊ����CN��ˮ�⣬��Ҫ��NaCN�ܽ��ڽ�Ũ��NaOH��Һ�У�Ȼ���ˮϡ�ͣ���2�����⿼�����ʽ����д��ClCN�ĵ���ʽ������HCN��HCN�ĵ���ʽΪH��CN����ClCN�ĵ���ʽΪ![]() ����3���ٱ��⿼��������ԭ��Ӧ�е���ת�ƣ����ݻ�ѧ��Ӧ����ʽ��Na�Ļ��ϼ���0�ۡ���1�ۣ����ϼ����ߣ�C��0�ۡ���2�ۣ�NH3��H�ɣ�1�ۡ�0�ۣ�����1molNaCN������1molNH3����ת�Ƶ������ʵ���1��3mol=3mol���ڱ��⿼���Ȼ�ѧ��Ӧ����ʽ���㣬CH4(g)=C(s)+2H2(g) �٣�2HCN(g)=2C(s)+H2(g)+N2(g) �ڣ�N2(g)+3H2(g) 2NH3(g) �ۣ�����Ŀ�귴Ӧ���̷�ʽ����ˢ٣���/2����/2�ó���H=��H1����H2/2����H3/2��
����3���ٱ��⿼��������ԭ��Ӧ�е���ת�ƣ����ݻ�ѧ��Ӧ����ʽ��Na�Ļ��ϼ���0�ۡ���1�ۣ����ϼ����ߣ�C��0�ۡ���2�ۣ�NH3��H�ɣ�1�ۡ�0�ۣ�����1molNaCN������1molNH3����ת�Ƶ������ʵ���1��3mol=3mol���ڱ��⿼���Ȼ�ѧ��Ӧ����ʽ���㣬CH4(g)=C(s)+2H2(g) �٣�2HCN(g)=2C(s)+H2(g)+N2(g) �ڣ�N2(g)+3H2(g) 2NH3(g) �ۣ�����Ŀ�귴Ӧ���̷�ʽ����ˢ٣���/2����/2�ó���H=��H1����H2/2����H3/2��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ͭ��Ʒ�к���Zn��Ag��Au�����ʣ���ͼ��ʾ����CH3OH-����ȼ�ϵ�ص������ͭ��Һ���պϵ��K���е�⡣����˵���в���ȷ���ǣ� ��

A. ��ظ�����ӦʽΪCH3OH -6e-+8OH-=CO32-+ 6H2O
B. ͨ��һ��ʱ���Ag��Au���ʽ��������ڵ��۵ײ�
C. ����ͭ�缫��������6.4g����ͭ�缫���ش���6.4g
D. ���������ҳش�ͭ�ʹ�ͭ�ֱ�Ϊ����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ�������������������,���й�����û�з�����ѧ�仯���ǣ� ��
A. �û���̿ȥ�����������ζ
B. ��������Һ���ͭ�������ͭ��
C. ��һ����������ʯ�ҡ���ƺ�ˮ������ʯ��ϼ�ũҩ(�غ�ɫ)
D. �Ŵ����������ʳƷ���Ƿ��о綾����˪(���������ʵ�As2O3)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����б仯����Ҫ�����ʵ���������������ɵ��ǣ� ��
A.SO2��SO32��B.PCl3��PCl5C.MnO4����Mn2+D.Cl2��HClO
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����10mL0.1mol/L�İ�ˮ��10mL0.1mol/L�������Ϻ���Һ�и������ӵ����ʵ���Ũ���ɴ�С��˳���ǣ�������
A. c��Cl������c��NH4+����c��OH������c��H+��
B. c��Cl������c��NH4+����c��H+����c��OH����
C. c��H+����c��OH������c��Cl������c��NH4+��
D. c��H+����c��Cl������c��NH4+����c��OH����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��Ԫ�����ڱ���һ���֣�A��B��C��Ϊ������Ԫ�أ�A��C����Ԫ�ص�ԭ�Ӻ��������֮�͵���B����������B��ԭ�Ӻ�������������������ȡ��ش�
![]()
(1)д��Ԫ�ط��ţ�A ____��C ___��
(2)BԪ��λ��Ԫ�����ڱ���____���ڵ�____�壻������������Ӧˮ����Ļ�ѧʽΪ____��
(3)A���⻯��ĵ���ʽΪ _________�� A���⻯����������������ˮ���ﷴӦ�Ļ�ѧ����ʽΪ____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�������ͼ����ᰬ˾���(F)��һ�ֺϳ�·�����£�


��֪��
�ش��������⣺
��1��A�Ļ�ѧ������____________��F�к��������ŵ�������___________________��
��2����B����C�ķ�Ӧ����Ϊ____________����D����E�ķ�Ӧ����Ϊ____________��
��3��B�Ľṹ��ʽΪ____________��
��4����C����D�Ļ�ѧ����ʽΪ____________��
��5����ȡ�������廯����X��E��ͬ���칹�壬1molX��������NaHCO3��Ӧ������44.8L����״����CO2����˴Ź���������ʾ��5�ֲ�ͬ��ѧ�������⣬��������֮��Ϊ9:2:2:2:1��д��2�ַ���Ҫ���X�Ľṹ��ʽ��________________________________________________��
��6��д���Ա��״��ͱ�����Ϊԭ���Ʊ�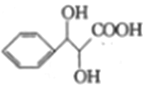 �ĺϳ�·��_____________���������Լ���ѡ����
�ĺϳ�·��_____________���������Լ���ѡ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������Һ�У���������һ���ܹ�����������ǣ� ��
A.��ɫ��Һ�У�Na+��Cl��SO42����Cu2+
B.ʹ��ɫʯ����Һ������Һ�У�Na+��Ca2+��C032����Cl��
C.��SO42������Һ�У�K+��Ba2+��CI����Br��
D.������Һ�У�Na+��S042����Cl����NH4+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ����
A. ��ӦMgO(s)+C(s)=Mg(s)+CO(g)�������²����Է����У���÷�Ӧ����H��0
B. ԭ���������ܵ�����ȡ�������ԭ��صķ�Ӧ���������ԭ����
C. 0.1 mol��L��1CH3COOH��Һ��ˮϡ�ͺ���Һ��![]() ��ֵ��С
��ֵ��С
D. ��¯�г�����CaSO4���ñ���Na2CO3��Һ���ݣ��ٽ���������ϡ�����ܽ��ȥ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com