
| A. | v(H2)=0.009mol•(L•s) -1 | B. | v(CO)=0.009mol•(L•min)-1 | ||
| C. | v(C)=0.00015 mol•(L•s) -1 | D. | v(H2O)=0.09mol•(L•min)-1 |
分析 根据v=$\frac{△c}{△t}$计算v(H2O),再根据同一化学反应中不同物质表示的反应速率之比等于化学计量数之比计算其它物质表示的速率,注意C是固态,浓度是常数,不能用固态物质浓度的变化表示反应速率.
解答 解:v(H2O)=$\frac{\frac{0.45mol}{10L}}{5min}$=0.009mol•(L•min)-1,同一化学反应,用不同物质表示的反应速率之比等于化学计量数之比,v(H2)=v(CO)=v(H2O)=0.009mol•(L•min)-1,故AD错误,D正确,由于C(碳)是固态,浓度是常数,不能用固态物质浓度的变化表示反应速率,故C错误,故选:B.
点评 本题考查化学反应速率,比较基础,侧重考查对速率定义的理解,有利于基础知识的巩固.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ②④⑤ | C. | ②③④ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 周期表中前四周期中的六种元素A、B、C、D、E、F原子序数依次增大,已知A原子2p轨道有3个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的晶体熔点在同周期元素形成的单质中是最高的;F2+核外各亚层电子均已充满.
周期表中前四周期中的六种元素A、B、C、D、E、F原子序数依次增大,已知A原子2p轨道有3个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的晶体熔点在同周期元素形成的单质中是最高的;F2+核外各亚层电子均已充满.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
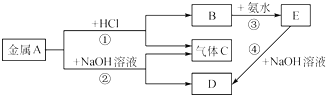
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 化合物AX3和单质X2在一定条件下反应可生成化合物AX5.回答下列问题:
化合物AX3和单质X2在一定条件下反应可生成化合物AX5.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸铜溶液 | B. | 稀硝酸 | C. | 盐酸 | D. | 硝酸银溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com