
【题目】a、b、c、d、e均为周期表前四周期元素,原子序数依次增大,相关信息如下表所示。
a | 原子核外电子分别占3个不同能级,且每个能级上排布的电子数相同 |
b | 基态原子的p轨道电子数比s轨道电子数少1 |
c | 在周期表所列元素中电负性最大 |
d | 位于周期表中第4纵行 |
e | 基态原子M层全充满,N层只有一个电子 |
请回答:
(1)d属于______区的元素,其基态原子的价电子排布图为_____________。
(2)b与其同周期相邻元素第一电离能由大到小的顺序为__________(用元素符号表示)。
(3)c的氢化物水溶液中存在的氢键有________种,任意画出一种_________。
(4)a与其相邻同主族元素的最高价氧化物的熔点高低顺序为___________(用化学式表示)。若将a元素最高价氧化物水化物对应的正盐酸根离子表示为A,则A的空间构型为____________;A的中心原子的轨道杂化类型为______________,与A互为等电子体的一种分子为____________(填化学式)。
(5)e与Au的合金可形成面心立方最密堆积的晶体,在晶胞中e原子处于面心,该晶体具有储氢功能,氢原子可进入到由e原子与Au原子构成的四面体空隙中,储氢后的晶胞结构与金刚石晶胞结构相似,该晶体储氢后的化学式为______________,若该晶体的相对分子质量为M,密度为a g/cm3,则晶胞的体积为________(用NA表示阿伏加德罗常数的值)。
【答案】d![]() N>O>C4F-H…F或F-H…O或O-H…F或O-H…OSiO2>CO2平面三角形sp2SO3 或BF3H4Cu3Au
N>O>C4F-H…F或F-H…O或O-H…F或O-H…OSiO2>CO2平面三角形sp2SO3 或BF3H4Cu3Au![]()
【解析】
a、b、c、d、e均为周期表前四周期元素,原子序数依次增大,a原子核外电子分占3个不同能级,且每个能级上排布的电子数相同,核外电子排布为1s22s22p2,故a为C元素;b元素基态原子的p轨道电子数比s轨道电子数少1,核外电子排布为1s22s22p3,故b为N元素;c在周期表所列元素中电负性最大,则c为F元素;d位于周期表中第4纵行,且处于第四周期,故d为Ti;e的基态原子M层全充满,N层只有一个电子,则核外电子数为2+8+18+1=29,故e为Cu,据此解答。
(l)d为Ti元素,属于d区的元素,基态原子的价电子排布3d24s2,故其基态原子的价电子排布图为![]() ,故答案为:d;
,故答案为:d;![]() ;
;
(2)与b同周期相邻元素分别为C、O,同周期随原子序数增大,第一电离能呈增大趋势,但N元素原子2p能级容纳3个电子,为半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能由大到小的顺序为:N>O>C,故答案为:N>O>C;
(3)c的氢化物为HF,水溶液中存在的氢键有![]() 、
、![]() 、
、![]() 、
、![]() ,共4种,故答案为:4;
,共4种,故答案为:4;![]() 、
、![]() 、
、![]() 、
、![]() 任意一种;
任意一种;
(4)a与其相邻同主族元素的最高价氧化物分别为CO2、SiO2,前者属于分子晶体,后者属于原子晶体,故熔点高低顺序为SiO2>CO2.a元素最高价氧化物水化物对应的正盐酸根离子为CO32-,离子中C原子价层电子对数=3+![]() =3,没有孤电子对,故碳酸根离子为平面三角形结构,中心C原子的轨道杂化类型为 sp2杂化;与CO32-互为等电子体的一种分子为SO3等,故答案为:SiO2>CO2;平面三角形;sp2杂化;SO3;
=3,没有孤电子对,故碳酸根离子为平面三角形结构,中心C原子的轨道杂化类型为 sp2杂化;与CO32-互为等电子体的一种分子为SO3等,故答案为:SiO2>CO2;平面三角形;sp2杂化;SO3;
(5)Cu与Au的合金可形成面心立方最密堆积的晶体,在晶胞中Cu原子处于面心,Au原子处于顶点,该晶体具有储氢功能,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中,储氢后的 晶胞结构与金刚石晶胞结构相似,金刚石晶胞结构为![]() ,则形成的晶体中晶胞中原子为H原子,共有有4个,Cu原子数目为6×
,则形成的晶体中晶胞中原子为H原子,共有有4个,Cu原子数目为6×![]() =3,Au原子数目为8×
=3,Au原子数目为8×![]() =1,该晶体储氢后的化学式为H4Cu3Au,若该晶体的相对分子质量为M,晶胞质量为
=1,该晶体储氢后的化学式为H4Cu3Au,若该晶体的相对分子质量为M,晶胞质量为![]() g,晶体密度为ag/cm3,则晶胞的体积为
g,晶体密度为ag/cm3,则晶胞的体积为![]() g÷ag/cm3=
g÷ag/cm3=![]() cm3,故答案为:H4Cu3Au;
cm3,故答案为:H4Cu3Au; ![]() cm3。
cm3。


 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:高中化学 来源: 题型:
【题目】ClO2是新一代饮用水的消毒剂,我国许多自来水厂采用ClO2代替Cl2来进行自来水消毒。请回答下列有关问题:
(1)ClO2读作____________,它属于________(选填“单质”“氧化物”或“混合物”)。
(2)ClO2中氯元素的化合价为__________。
(3)我国最近成功研制出制取ClO2的新方法,其反应的微观过程如图所示:

该反应的化学方程式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示,下列分析正确的是
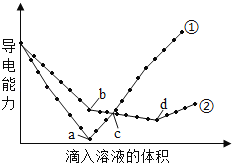
A. ②代表滴加H2SO4溶液的变化曲线
B. b点,两反应物物质的量之比为1: 2
C. a、d两点对应的溶液均显中性
D. c点,两溶液中含有相同物质的量浓度的OH﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t℃时,AgX(X=Cl、Br)的溶度积与c(Ag+)和c(X-)的相互关系如下图所示,其中A线表示AgCl,B线表示AgBr,已知p(Ag+)=-lgc(Ag+),p(X-)=-lgc(X-)。下列说法正确的是( )

A. c点可表示AgCl的不饱和溶液
B. b点的AgCl溶液加入AgNO3晶体可以变成a点
C. t℃时,AgCl(s)+Br-(aq)![]() AgBr(s)+Cl-(aq)平衡常数K=10-4
AgBr(s)+Cl-(aq)平衡常数K=10-4
D. t℃时,取a点的AgCl溶液和b点AgBr溶液等体积混合,会析出AgBr沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式碳酸镁可用于牙膏、医药和化妆品等工业,化学式为4MgCO3·Mg(OH)2·5H2O,某碱式碳酸镁中含有SiO2杂质,为测定其纯度,某兴趣小组设计了如下几个方案:
方案I取一定质量的样品,与硫酸充分反应,通过测定生成CO2的质量计算纯度

(1)乙中发生反应的方程式为____________。
(2)仪器接口的连接顺序为(装置可以重复使用)a___________,丁的作用是__________。
(3)当样品充分反应完后,缓慢通入空气的目的是:____________。
方案Ⅱ①称取碱式碳酸镁样品mg;②将样品充分高温煅烧,冷却后称量;③重复操作②,测得剩余固体质量为m1g/。
(4)下列仪器中,该方案不会用到的是____________。

(5)判断样品完全分解的方法是_______;本实验至少需要称量_______次。
(6)有同学认为方案Ⅱ高温煅烧的过程中会发生MgCO3 +SiO2![]() MgSiO3 +CO2↑,会导致测定结果有误,你认为这位同学的观点正确吗?______。(填“正确”或“错误”)请说明理由:____________。
MgSiO3 +CO2↑,会导致测定结果有误,你认为这位同学的观点正确吗?______。(填“正确”或“错误”)请说明理由:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 16 g由O2和O3的混合气体中含有的分子数为0.5NA
B. 2.3 g金属钠在装有氧气的集气瓶中完全燃烧,转移的电子数为0.1NA
C. 6.4 g CaC2晶体中所含的离子总数为0.3NA
D. 0.3 mol AgNO3受热完全分解(2AgNO3![]() 2Ag+2NO2↑+O2↑),用排水法收集到气体的分子数为0.25NA
2Ag+2NO2↑+O2↑),用排水法收集到气体的分子数为0.25NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表述正确的是
A. 二氧化硅是将太阳能转化变为电能的常用材料
B. 玻璃、水晶、玛瑙的主要成分都是硅酸盐
C. 水玻璃可用于生产黏合剂和防火剂
D. 二氧化硅既能跟HF反应,又能跟NaOH反应,因此二氧化硅是两性氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增大。其中A原子核外有三个未成对电子;A与B可形成离子化合物B3A2;C元素是地壳中含量最高的金属元素;D原子核外的M层中有两对成对电子;E原子核外最外层只有1个电子,其余各层电子均充满。请根据以上信息,回答下列问题(答题时,A、B、C、D、E用所对应的元素符号表示):
(1)B的轨道排布式是_____________________________________,A、B、C、D的第一电离能由小到大的顺序为___________________________________________。
(2)B的氯化物的熔点远高于C的氯化物的熔点,理由是________________________;
(3)A的最高价含氧酸根离子中,其中心原子采取____________杂化,D的低价氧化物分子的空间构型是___________________________。
(4)A、E形成某种化合物的晶胞结构如图所示,则其化学式为________________;(每个球均表示1个原子) 若相邻A原子和E原子间的距离为a nm,阿伏伽德罗常数为NA,则该晶体的密度为_____________g/cm3(用含a、NA的符号表示)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com