
在100℃时,将N2O4、NO2分别充入两个各为1 L的密闭容器中,反应过程中浓度变化如下:[2NO2(g)  N2O4(g) ΔH<0]
N2O4(g) ΔH<0]
| 容器 | 物质 | 起始浓度/(mol·L-1) | 平衡浓度/(mol·L-1) |
| Ⅰ | N2O4 | 0.100 | 0.040 |
| NO2 | 0 | 0.120 | |
| Ⅱ | N2O4 | 0 | 0.014 |
| NO2 | 0.100 | 0.072 |
下列说法正确的是
A. 平衡时,Ⅰ、Ⅱ中反应物的转化率α(N2O4)<α(NO2)
B. 平衡时,Ⅰ、Ⅱ中上述正反应的平衡常数K(Ⅰ) = 2K(Ⅱ)
C. 平衡后,升高相同温度,以N2O4表示的反应速率ν(Ⅰ)<ν(Ⅱ)
D. 平衡后,升高温度,Ⅰ、Ⅱ中气体颜色都将变深
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
自然界中的CaF2又称萤石,是一种难溶于水的固体,属于典型的离子晶体。下列一定能说明CaF2是离子晶体的实验是( )
A.CaF2难溶于水,其水溶液的导电性极弱
B.CaF2的熔、沸点较高,硬度较大
C.CaF2固体不导电,但在熔融状态下可以导电
D.CaF2在有机溶剂(如苯)中的溶解度极小
查看答案和解析>>
科目:高中化学 来源: 题型:
将4.0 mol PCl3和2.0 mol Cl2充入体积不变的密闭容器中,在一定条件下发生下述反应:PCl3(g)+Cl2(g)PCl5(g)。达到平衡时,PCl5为0.80 mol,如果此时移走2.0 mol PCl3和1.0 mol Cl2,在相同温度下再达平衡时PCl5的物质的量是( )
A.0.8 mol B.0.4 mol
C.小于0.4 mol D.大于0.4 mol,小于0.8 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学科研小组研究在其他条件不变时,改变某一条件对A2(g)+3B2(g)2AB3(g)化学平衡状态的影响,得到如图所示的变化规律(图中T表示温度)( )
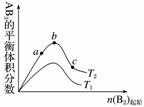
由此可得出的结论是
A.反应速率a>b>c
B.达到平衡时A2的转化率大小为b>a>c
C.若T2>T1,则正反应一定是放热反应
D.达到平衡时,AB3的物质的量大小为c>b>a
查看答案和解析>>
科目:高中化学 来源: 题型:
在一个体积为2 L的密闭容器中,高温下发生反应:Fe(s)+CO2(g)FeO(s)+CO(g)。其中CO2、CO的物质的量(mol)随时间(min)的变化关系如图所示。
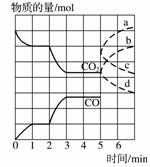
(1)反应在1 min时第一次达到平衡状态,固体的质量增加了3.2 g。用CO2的浓度变化表示的反应速率v(CO2)=__________。
(2)反应进行至2 min时,若升高温度,曲线发生的变化如图所示,3 min时再次达到平衡,则ΔH______0(填“>”、“<”或“=”)。
(3)5 min时再充入一定量的CO(g),平衡发生移动。下列说法正确的是________(填写字母)。
a.v正先增大后减小 b.v正先减小后增大
c.v逆先增大后减小 d.v逆先减小后增大
表示n(CO2)变化的曲线是__________(填写图中曲线的字母编号)。
(4)请用固态物质的有关物理量来说明该反应已经达到化学平衡状态:________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
铁及其化合物在日常生活中很常见
(1)氧化铁是重要工业颜料,用废铁屑制备它的流程如下:
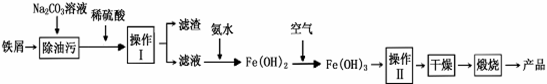 |
回答下列问题:
①操作II所包含的两项主要基本操作是 。 上述流程中,Fe(OH)2转化成Fe(OH)3时的化学方程式为 。
②将FeCl2溶液高温水解、氧化也可直接制得氧化铁,请写出反应的化学方程式: 。
(2)有些同学认为用KMnO4溶液能进行绿矾(FeSO4·7H2O)产品中铁元素含量的测定,反应的离子方程式为: ,该滴定过程中 (填“是”或“否”)还需要指示剂。
实验步骤如下:
a. 考虑绿矾产品可能因为保存不当被空气中氧气所氧化,所以事先取少量绿矾产品溶于水,滴加 溶液进行验证。
b.称取2.850g绿矾产品,溶解,在250mL容量瓶中定容;
c. 量取25.00mL待测溶液于锥形瓶中;
d. 用硫酸酸化的0.01000 mol·L-1KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL。
请完成下列问题:
① 实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250 mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需 。
② 某同学设计的下列滴定方式,最合理的是________。(夹持部分略去)(填字母序号)

③计算上述样品中FeSO4·7H2O的质量分数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
为了比较铁和铜金属活动性强弱,某研究小组的同学设计了如下一些方案,并将实验结果记录如下:
| 方案 | 现象或产物 |
| |
| ①将铁片置于CuSO4溶液中 | 铁片上有亮红色物质析出 |
| |
| ②将铁丝和铜丝分别在氯气中燃烧 | 产物分别为FeCl3和CuCl2 |
| |
| ③将铁片和铜片分别放入热浓硫酸中 | 产物分别为Fe2(SO4)3和CuSO4 |
| |
| ④将铁片和铜片分别置于稀硫酸溶液中 | 铁片上有气泡,铜片上不产生气泡 |
| |
| ⑤将铁片和铜片同时插入盛有稀硫酸的烧杯中,并用导线连接 | 铁片溶解,铜片上有气泡产生 | ||
能根据以上各种现象或产物证明铁的金属活动性比铜强的方案一共有( )。
A.2种 B.3种
C.4种 D.5种
查看答案和解析>>
科目:高中化学 来源: 题型:
下表为某轻质纯碱产品说明书:
|
| 化学名:碳酸钠,俗称苏打 |
| 性状:白色粉末,易溶于水,水溶液呈中性 | |
| 化学式:Na2CO3 | |
| 用途:重要的基本化工原料之一,在纺织、玻璃、制皂、造纸等领域都有广泛应用 |
其中有错误的一项是 ( )。
A.化学名 B.性状
C.化学式 D.用途
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于电解质的叙述正确的是( )
A.电解质溶液的浓度越大,其导电性能一定越强
B.强酸和强碱一定是强电解质,不管其水溶液浓度的大小,都能完全电离
C.强极性共价化合物不一定都是强电解质
D.多元酸、多元碱的导电性一定比一元酸、一元碱的导电性强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com