
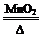 2KCl+3O2↑
2KCl+3O2↑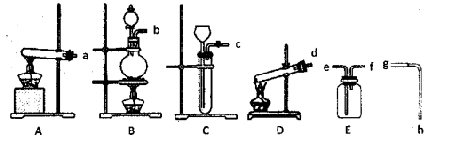
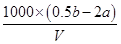 (3分)
(3分)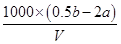 mol·L- 1。
mol·L- 1。

 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:不详 题型:填空题
| 操作步骤 | 实验现象 |
| 取1g纯净的NaCl,加3mL水配成溶液。 | 溶液无变化 |
| 滴入5滴淀粉溶液和1mL 0.1 mol·L-1 KI溶液,振荡。 | 溶液无变化 |
| 然后再滴入1滴1mol·L-1的H2SO4,振荡。 | 溶液变蓝色 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
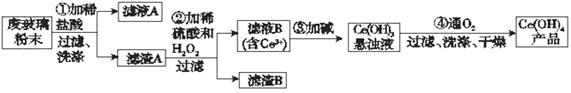
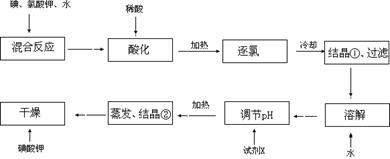
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
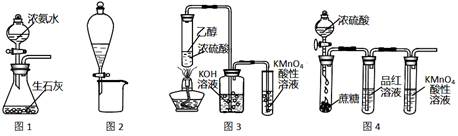
| A.图1所示装置可制取氨气 |
| B.图2所示装置可分离CH3CH2OH和CH3COOC2H5混合液 |
| C.图3所示装置可制取乙烯并验证其易被氧化 |
| D.图4所示装置可说明浓H2SO4具有脱水性、强氧化性,SO2具有漂白性、还原性 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 选项 | 实验操作 | 实验目的或结论 |
| A | 向某钠盐溶液中加入过量盐酸,产生能使澄清石灰水变浑浊的无色气体 | 该溶液为Na2CO3溶液 |
| B | 在有镀层的铁片上,用刀刻一槽,在槽上滴入少量0.1 mol/L盐酸,一段时间后滴入KSCN溶液,无红色出现 | 一定是镀锡的马口铁片 |
| C | 配制SnCl2溶液时,先将SnCl2溶于适量浓盐酸,再用蒸馏水稀释,最后在试剂瓶中加入少量的锡粒 | 抵制Sn2+水解,并防止Sn2+被氧化为Sn4+ |
| D | 向等浓度的NaCl和KI的混合溶液中,逐滴加入AgNO3溶液,溶液中先产生黄色沉淀,后产生白色沉淀 | Ksp(AgCl)< Ksp(AgI) |
查看答案和解析>>
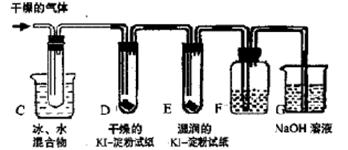
科目:高中化学 来源:不详 题型:实验题
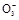 氧化成I
氧化成I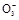 ,被H2O2或O2等氧化成I2;
,被H2O2或O2等氧化成I2;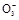 能被HS
能被HS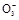 还原成I2。
还原成I2。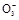 中的哪一种。
中的哪一种。| 实验步骤 | 预期现象与结论 |
| 步骤1:取少量上述溶液注入试管中,滴入几滴淀粉溶液振荡 | 若溶液显 ,则假设1成立;否则,假设1不成立,再进行步骤2 |
| 步骤2: | 若溶液显蓝色,则假设2成立,反应的离子方程式为 ; 否则,假设2不成立,再进行步骤3 |
| 步骤3: | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 测定等浓度的Na2CO3和Na2SO3 溶液的pH | 前者pH比后者的大 | 非金属性:S>C |
| B | SO2通入酸性高锰酸钾溶液 | 高锰酸钾溶液褪色 | SO2具有漂白性 |
| C | 向某溶液中滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中无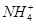 |
| D | 向等浓度的KCl、KI混合液中滴加AgNO3溶液 | 先出现黄色沉淀 | Ksp(AgCl)> Ksp(AgI) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com