
【题目】电化学原理在防止金属腐蚀、能量转换、物质合成等方面应用广泛. 
(1)为了减缓海水对钢闸门A和C的腐蚀,图1中,材料B可以选择(填字母序号). a.锌板 b.铜板 c.碳棒
图2中,钢闸门C作极.若用氯化钠溶液模拟海水进行实验,D为石墨块,则D上的电极
反应式为 , 检测该电极反应产物的试剂是 .
(2)微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图3所示(质子交换膜只允许H+自由通过).该电池的正极反应式为 .
(3)电渗析法处理厨房垃圾发酵液,同时得到乳酸(弱酸)的原理如图4所示(图中“HA”表示乳酸 分子,A﹣表示乳酸根离子).
①阳极的电极反应式为 .
②简述浓缩室中得到浓乳酸的原理: .
【答案】
(1)a;阴;2Cl﹣﹣2e﹣═Cl2↑;湿润的淀粉碘化钾试纸放在阳极附近,试纸变蓝,证明生成氯气
(2)O2+4e﹣+4H+═2H2O
(3)4OH﹣﹣4e﹣═2H2O+O2↑;阳极OH﹣放电,c(H+)增大,H+从阳极通过阳离子交换膜进入浓缩室,A﹣通过阴离子交换膜从阴极进入浓缩室,H++A﹣═HA,乳酸浓度增大
【解析】解:(1)形成原电池时,Fe作正极被保护,则要选择活泼性比Fe强的金属作负极,所以选锌;Fe作阴极被保护,则钢闸门C做阴极;电解氯化钠溶液时阳极上氯离子失电子生成氯气,其电极反应为:2Cl﹣﹣2e﹣═Cl2↑,检验氯气用湿润的淀粉碘化钾试纸,即用湿润的淀粉碘化钾试纸放在阳极附近,试纸变蓝,证明生成氯气;所以答案是:a;阴;2Cl﹣﹣2e﹣═Cl2↑;湿润的淀粉碘化钾试纸放在阳极附近,试纸变蓝,证明生成氯气;(2)根据图知,负极上C6H12O6失电子,正极上O2得电子和H+反应生成水,负极的电极反应式为C6H12O6+6H2O﹣24e﹣=6CO2+24H+,正极的电极反应式为O2+4e﹣+4H+═2H2O,所以答案是:O2+4e﹣+4H+═2H2O;(3)①阳极上是阴离子氢氧根离子发生失电子的氧化反应,电极反应式为:4OH﹣﹣4e﹣═2H2O+O2↑,所以答案是:4OH﹣﹣4e﹣═2H2O+O2↑;
②在电解池的阳极上是OH﹣放电,所以c(H+)增大,并且H+从阳极通过阳离子交换膜进入浓缩室;根据电解原理,电解池中的阴离子移向阳极,即A﹣通过阴离子交换膜从阴极进入浓缩室,这样:H++A﹣═HA,乳酸浓度增大,
所以答案是:阳极OH﹣放电,c(H+)增大,H+从阳极通过阳离子交换膜进入浓缩室,A﹣通过阴离子交换膜从阴极进入浓缩室,H++A﹣═HA,乳酸浓度增大.
【考点精析】掌握金属的电化学腐蚀与防护是解答本题的根本,需要知道金属的保护:涂保护层;保持干燥;改变金属的内部结构,使其稳定;牺牲阳极的阴极保护法即用一种更为活泼的金属与要保护的金属构成原电池;外加电源法.


科目:高中化学 来源: 题型:
【题目】某学生为了探究钠与CO2的反应,利用如图装置进行实验。(巳知PdCl2能被CO还原得到黑色的Pd)
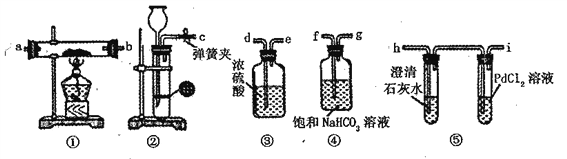
(1)请将上图各装置连接完整(填写装置中字母):c→ f→ g→_____ →______→a →b →h。
(2)若用稀盐酸与CaCO3反应制备CO2在加稀盐酸时,发现CaCO3与稀盐酸不能接触,而稀盐酸又不够了,为使反应能顺利进行,可向长颈漏斗中加入的试剂是_________。
A.H2SO4溶液 B.CCl4 C.苯 D.稀硝酸
(3)检查装置气密性并装好药品后,点燃酒精灯之前应进行的操作是打开弹簧夹,让CO2充满整个装置,当观察到__________________时再点燃酒精灯。
(4)若反应过程中CO2足量,探究钠与CO2充分反应后生成物可能的情况,某同学认为生成的物质仅为Na2CO3固体,老师认为仅生成Na2CO3是不可能的,请你说出不可能的理由_______。
(5)假如反应过程中有下列两种情况,分别写出两种情况下钠与CO2反应的化学方程式。
I.装置⑤PdCl2溶液中观到有黑色沉淀装置①中固体成分只有一种,且向固体中加入稀盐酸产生能使澄清石灰水变浑浊的气体:_________________________________。
Ⅱ装置①中钠的质量为0.46g,充分反应后,将装置①中的固体加入到足量盐酸中产生224mL标准状况)CO2气体,且溶液中还有固体残留_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱性硼化钒﹣﹣空气电池工作时反应为:4VB2+11O2=4B2O3+2V2O5 , 室温下用该电池为电源,用惰性电极电解饱和氛化钠溶液,装置如图.当外电路中通过0.04mol电子时,乙装置中溶液的体积为400mL.则下列说法正确的是( ) 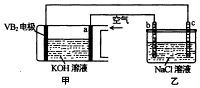
A.外电路中电子由a电极流向b电极
B.电极上生成气体的体积为4.48L
C.乙装置中溶液的pH为13
D.VB2电极发生的电极反应为:VB2+11H2O﹣22e﹣=VB2+2B2O3+22H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X和Y能发生如下反应:X+Y H2O+盐,下列有关X和Y所属种类的说法中一定不正确的是 ( )
A | B | C | D | |
X | 酸性氧化物 | 碱性氧化物 | 盐 | 酸性氧化物 |
Y | 碱 | 酸 | 碱 | 碱性氧化物 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是( )
A.乙烯能与溴的四氯化碳溶液反应使溶液逐渐褪色
B.乙醛能与新制氢氧化铜反应产生砖红色沉淀
C.糖类物质都能发生水解反应
D.在一定条件下,氨基酸之间能发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:HCl+NH3=NH4Cl(固体)如图所示,抽去装置中的玻璃片,使两种气体充分反应(整个过程中认为装置气密性良好),等温度恢复到原来温度.下列说法正确的是( ) 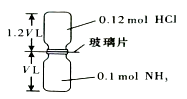
A.反应后瓶内压强是反应前的 ![]()
B.装置中氢元素的总质量为0.42 g
C.生成物的分子数目为0.1 NA
D.反应结束后,两个集气瓶很容易分开
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是中学化学教科书中元素周期表的一部分,除标出的元素外,表中的每个编号表示一种元素,请根据要求回答问题.
族 | IA | 0 | |||||||
1 | ① | II A | III A | IV A | V A | VI A | VIIA | ||
2 | ② | ③ | ⑥ | Ne | |||||
3 | ④ | ⑤ | Al | S | |||||
(1)⑥表示的元素是;
(2)②的原子结构示意图是;
(3)由①和③两种元素组成的化合物的化学式是;
(4)④和⑤两种元素的金属性强弱顺序是④⑤(填“<”或“>”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分析下列各项结构的规律,按此规律排布第10项的分子式应为( ) 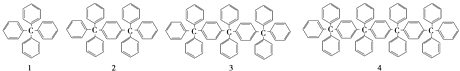
A.C198H146
B.C196H155
C.C196H146
D.C198H155
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com