
实验室配制500mL 0.2mol/L的FeSO4溶液,实验操作步骤有:
①在天平上称出27.8g绿矾,把它放在烧杯里,用适量的蒸馏水使它完全溶解
②把制得的溶液小心地注入500mL容量瓶中
③继续向容量瓶中加蒸馏水至液面距刻度1~2cm处.改用胶头滴管小心滴加蒸馏水至溶液凹液面底部与刻度线相切
④用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心转入容量瓶,并轻轻摇匀
⑤将容量瓶塞塞紧,充分摇匀
请填写下列空白:
(1)操作步骤的正确顺序为(填序号) ①②④③⑤ .
(2)本实验用到的基本仪器已有烧杯、天平(带砝码、镊子)、玻璃棒,还缺少的仪器是
500mL容量瓶 、 胶头滴管 .
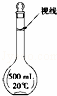
(3)某同学观察液面的情况如图所示,对所配溶液浓度有何影响?会 偏高 (填“偏高”、“偏低”或“无影响”).
(4)若出现如下情况,所配溶液浓度将偏高还是偏低:没有进行操作步骤④,会 偏低 ;加蒸馏水时不慎超过了刻度,会 偏低 .向容量瓶中转移溶液时(实验步骤②)不慎有液滴掉在容量瓶外面,会 偏低 .
(5)若实验过程中出现如下情况应如何处理?加蒸馏水时不慎超过了刻度,应 重新配制 .
| 配制一定物质的量浓度的溶液.. | |
| 专题: | 物质的量浓度和溶解度专题. |
| 分析: | (1)根据配制步骤是计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶来对操作顺序进行排序; (2)根据配制步骤是计算、称量、溶解、移液、洗涤、定容、摇匀、装瓶来分析需要的仪器; (3)根据c=并结合溶质的物质的量n和溶液的体积V的变化来进行误差分析; (4)根据c=并结合溶质的物质的量n和溶液的体积V的变化来进行误差分析; (5)配制过程中的操作失误,能补救就补救,不能补救就需重新配制. |
| 解答: | 解:(1)根据配制步骤是计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶可知正确的操作顺序是①②④③⑤,故答案为:①②④③⑤; (2)操作步骤有计算、称量、溶解、移液、洗涤、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解(可用量筒量取水加入烧杯),并用玻璃棒搅拌,加速溶解.冷却后转移到500mL容量瓶中,并用玻璃棒引流,洗涤烧杯、玻璃棒2﹣3次,并将洗涤液移入容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀.所以所需仪器有托盘天平、烧杯、玻璃棒、500mL容量瓶、胶头滴管.故还缺少的仪器是500mL容量瓶、胶头滴管,故答案为:500mL容量瓶;胶头滴管; (3)据图可知,是定容时俯视液面,则会导致溶液体积偏小,浓度偏高,故答案为:偏高; (4)没有进行操作步骤④,会导致溶质的损失,则浓度偏低;加蒸馏水时不慎超过了刻度线,则溶液体积偏大,浓度偏低;向容量瓶中转移溶液时(实验步骤②)不慎有液滴掉在容量瓶外面,会导致溶质的损失,则浓度偏低;故答案为:偏低;偏低;偏低; (5)一旦加蒸馏水时不慎超过了刻度线,则无法补救,故需重新配制,故答案为:重新配制. |
| 点评: | 本题考查了一定物质的量浓度溶液的配制过程中的计算和误差分析,属于基础型题目,难度不大. |


科目:高中化学 来源: 题型:
将淀粉水解,并用新制的氢氧化铜悬浊液检验其水解产物的实验中,要进行的主要操作是
①加热 ②滴入稀硫酸 ③加入新制的氢氧化铜悬浊液 ④加入足量的氢氧化钠溶液.
A.①→②→③→④→① B.②→①→④→③→①
C.②→④→①→③→① D.③→④→①→②→①
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.室温时某溶液的pH<7,则该物质一定是酸或强酸弱碱盐
B.已知室温时,0.1mol·L-1某一元酸HA的电离平衡常数为1×10-7,则该酸的电离度约为0.01%
C.0.02mol·L-1CH3COOH溶液和0.01mol·L-1NaOH溶液等体积混合,则溶液中:
2c(H+) + c(CH3COOH) = 2 c(OH-) + c(CH3COO-)
D.在温度不变的条件下向CaSO4饱和溶液中加入Na2SO4溶液,CaSO4将会析出,但Ksp不会发生改变
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
|
| A. | 1mol任何气体所占体积都约为22.4L |
|
| B. | 1molH2O在标准状况下体积为22.4L |
|
| C. | 1mol气体体积为22.4L,则一定是标准状况 |
|
| D. | 气体摩尔体积不一定是22.4L/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
选择下列实验方法分离物质,将分离方法的序号填在横线上.
A.萃取分液法 B.加热分解法 C.结晶法D.分液法 E.蒸馏法 F.过滤法
(1)分离饱和食盐水与沙子的混合物 .
(2)从硝酸钾和氯化钠的混合溶液中获得硝酸钾 .
(3)分离水和汽油的混合物 .
(4)分离四氯化碳(沸点为76.75℃)和甲苯(沸点为110.6℃)的混合物 .
(5)从碘的水溶液里提取碘 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组离子在指定溶液中一定能大量共存的是
A.无色溶液中可能大量存在Al3+、NH 、Cl-、AO2-
、Cl-、AO2-
B.酸性溶液中可能大量存在Na+、MnO4-、SO 、I-
、I-
C.弱碱性溶液中可能大量存在Na+、K+、Cl-、HCO
D.0.1 mol·L-1FeCl3溶液中:Fe2+、NH 、SCN-、SO42-
、SCN-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W的气态氢化物溶于水溶液呈碱性,下列结论不正确的是
A.X、Y、Z中最简单氢化物稳定性最弱的是Y
| W | X | |
| Y | Z |
B.Z元素最高价氧化物对应水化物的酸性一定强于Y 元素
最高价氧化物对应水化物的酸性
C.Z元素单质在化学反应中只表现氧化性
D.X、Y、Z元素形成的单核阴离子半径最大的是Y
查看答案和解析>>
科目:高中化学 来源: 题型:
已知反应:2SO2(g)+O2(g) 2SO3(g) ΔH<0。某温度下,将2 mol SO2和1 mol O2置于10 L密闭容器中,反应达平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是
2SO3(g) ΔH<0。某温度下,将2 mol SO2和1 mol O2置于10 L密闭容器中,反应达平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是


A.由图甲知,A点SO2的平衡浓度为0.4 mol·L-1
B.由图甲知,B点SO2、O2、SO3 的平衡浓度之比为2∶1∶2
的平衡浓度之比为2∶1∶2
C.达平衡后,缩小容器容积,则反应速率变化图象可以用图乙表示
D.压强为0.50 MPa时不同温度下SO2转化率与温度关系如丙图,则T2>T1
查看答案和解析>>
科目:高中化学 来源: 题型:
三氧化二镍(Ni2O3)是一种重要的电子元件材料和蓄电池材料。工业上利用含镍废料(镍、铁、钙、镁合金为主)制取草酸镍(NiC2O4·2H2O),再高温煅烧草酸镍制取三氧化二镍。已知草酸的钙、镁、镍盐均难溶于水。根据下列工艺流程示意图回答问题。

(1)操作1为 。
(2)生产过程中多次进行过滤,实验室进行过滤操作中需用到玻璃棒,下列实验操作中哪些操作中玻璃棒的作用完全相同的是 (填选项字母)。
①配制0.1mol/L的H2SO4溶液
②测定Na2CO3溶液的pH
③用KI淀粉试纸检验溶液中的氧化性离子
④加热食盐溶液制备NaCl晶体
⑤配制20%的KNO3溶液
A.①⑤ B.②③ C.④⑤ D.①④
(3)加入H2O2发生的主要反应的离子方程式为 ;
加入Na2CO3溶液调pH至4.0~4.5,其目的为 ;
加入NH4F后除掉的杂质是 。
(4)草酸镍(NiC2O4·2H2O)在热空气中干燥脱水后在高温下煅烧三小时,制得Ni2O3,同时获得混合气体。草酸镍受热分解的化学方程式为 。
(5)工业上还可用电解法制取Ni2O3。用NaOH溶液调节NiCl2溶液的pH至7.5,加入适量Na2SO4后采用惰性电极电解。电解过程中产生的Cl2有80%在弱碱性条件下生成ClO-,再把二价镍氧化为三价镍。ClO-氧化Ni(OH)2生成Ni2O3的离子方程式为 。amol二价镍全部转化为三价镍时,外电路中通过电子的物质的量为 。
(6)电解法制取Ni2O3的实际过程中,有时获得一种结晶水合物,已知含1molNi的该物质中含有0.5mol结晶水。取该化合物20.2g进行充分加热,获得Ni2O3固体和0.2mol水,则该结晶水合物的化学式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com