
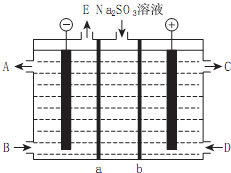
���� ��1��A�����ݽӴ���������Ĺ�ҵ���̺������豸��Ӧ�����жϣ�
B�����������������յķ���������Ũ�������յõ����������������жϣ�
C��FeS2����ʧ����S����ʧ����һ���ģ�����SԪ���غ㣬���ù�ϵʽ���㣻
D����������������������ķ�Ӧ�Ƿ��ȵĿ��淴Ӧ������ƽ���ƶ���ԭ���жϣ�
E����������������������ķ�Ӧ�Ƿ��ȷ�Ӧ�����������ȷ����ƶ������淽���ƶ���SO2��ת���ʻή�ͣ�
��2����SO2������ʯ��ˮ��Ӧ������������ƺ�ˮ��������ƺ����ᷴӦ��������ơ�ˮ�Ͷ�������
��n��SO2��=$\frac{10000��0.2%��1{0}^{3}L}{22.4L•mo{l}^{-1}}$=893mol����Ϲ�ϵʽ��ϵʽCaO��Ca��OH��2��SO2��CaSO3���㣻
��3���ٴ�CΪ�����֪��bΪ�����ӽ���Ĥ����aΪ�����ӽ���Ĥ����������ӦΪˮ�ŵ���������������������AΪ�������ƣ�EΪ������
������ӦΪ��������ŵ������������д�����ɣ�
��� �⣺��1��A�����ݽӴ���������Ĺ�ҵ���̺������豸�����жϣ��������������ڷ���¯�з�Ӧ���ɶ�������������ĽӴ��������ڽӴ����з����ģ����������������������������ɵģ���A��ȷ��
B������������98.3%��H2SO4������SO3�����յõ������̡����ᣬ������������������ֻ�����98.3%����B����
C���������m�ˣ�����Ϊ m��48% �ˣ���FeS2Ϊ x �ˣ�����������ĺ���Ϊ$\frac{32��2}{56+32��2}$������SԪ���غ㣬���ù�ϵʽ�ɿ�����
FeS2------------------2S
120 64
x m��48%
������ϵ��$\frac{120}{x}$=$\frac{64}{m��48%}$
��ã�x=$\frac{m��48%��120}{64}$������������ʧ2%����m��ʾΪ��$\frac{m��48%��120}{64}$��2%���������ʧ����������S��ʧΪ��$\frac{m��48%��120}{64}$��2%��$\frac{32��2}{56+32��2}$��
����ã�m��48%��2%���������ʧ��=$\frac{��ʧ���������}{���������}$��100%���������ݣ������ʧ��=$\frac{m��48%��2%}{m��48%}$��100%=2%��FeS2����ʧ����S����ʧ����һ���ģ���C����
D���Ӵ����ж���������������Ӧ��������������һ�����淴Ӧ����������ȣ�ѡ��400�桫500��ĸ��£�V2O5��������ԭ�����ڴ��¶ȴ����Ļ������Ӧ���ʺ�ƽ��ת���ʶ��ϸߣ����¶ȹ��ߣ�ƽ�������ƶ���ת���ʷ������ͣ���ѹ�£�ƽ��ת���ʽϸߣ�������ѹǿ��ƽ�����������ƶ��������������ת���ʣ����ǻ�����豸��ۺͺ������ӣ��ʽӴ���������������V2O5�����������¡���ѹ��
��D��ȷ��
E����������������������ķ�Ӧ�Ƿ��ȵĿ��淴Ӧ�������¶�ƽ�������ȷ����ƶ������淽���ƶ���SO2��ת���ʻή�ͣ���E����
��ѡ��AD��
��2������SO2������ʯ��ˮ��Ӧ������������ƺ�ˮ��������ƺ����ᷴӦ��������ơ�ˮ�Ͷ�������
�����Ļ�ѧ��Ӧ�ֱ�ΪCa��OH��2+SO2=CaSO3+H2O��CaSO3+H2SO4=CaSO4+SO2��+H2O��
�ʴ�Ϊ��Ca��OH��2+SO2=CaSO3+H2O��CaSO3+H2SO4=CaSO4+SO2��+H2O��
����ij���᳧ÿ���ŷŵ�1�������ף���״����β���к�0.2%�������������SO2����n��SO2��=$\frac{10000��0.2%��1{0}^{3}L}{22.4L•mo{l}^{-1}}$=893mol���ɹ�ϵʽCaO��Ca��OH��2��SO2��CaSO3��֪����Ҫ893molCaO������Ϊ893mol��56g/mol=50000g=50kg��
�ʴ�Ϊ��50��
��3���ٴ�CΪ�����֪���������Դ����������ŵ磬��bΪ�����ӽ���Ĥ��aΪ�����ӽ���Ĥ����������ӦΪˮ�ŵ��������������������ӣ���AΪ�������ƣ�EΪ������
�ʴ�Ϊ������H2��
������ӦΪ��������ŵ��������������Ӧ�����ӷ���ʽΪSO32-+H2O-2e-=SO42-+2H+��
�ʴ�Ϊ��SO32-+H2O-2e-=SO42-+2H+��
���� ���⿼���˽Ӵ���������Ĺ�ҵ���̣���ʧ�ʵļ��㡢��ѧƽ��������������ʵ�����⡢�����������Ⱦ�����Ρ���ѧ����ʽ����д����ϵʽ�ļ��㣬������ѧ���ķ��������������Ŀ��飬ע����յ��ԭ�����缫����ʽ����д��֪ʶ���ۺ���ǿ��


 ��У��������ĩ��̾�ϵ�д�
��У��������ĩ��̾�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���Ӱ뾶��Na+��Mg2+��Al3+��F- | |
| B�� | ���ȶ��ԣ�HCl��H2S��PH3��AsH3 | |
| C�� | ����ǿ����Al��OH��3��H2SiO3��H2CO3��H3PO4 | |
| D�� | �۵㣺SiO2��NaCl��Na��CO2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��������KI��Һ����������ɫ | |
| B�� | ���ۺ���ά�����ڶ��ǣ������ʽ��Ϊ��C6H10O5��n������Ϊͬ���칹�� | |
| C�� | ����һ�㲻����ˮ��û����ζ��û�л�ԭ�� | |
| D�� | ��ϡ���������£�����ˮ�����������Ǻ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| �ⶨʱ��/s | t1 | t2 | t3 | t4 |
| c��A��/mol•L-1 | 6 | 3 | 2 | 2 |
| c��B��/mol•L-1 | 5 | 3.5 | 3 | 3 |
| c��C��/mol•L-1 | 1 | 2.5 | 3 | 3 |
| A�� | �������з����ķ�ӦΪ2A+B?2C | |
| B�� | ���¶��£��˷�Ӧ��ƽ�ⳣ��Ϊ0.25 | |
| C�� | A��ƽ��ת���ʱ�B��ƽ��ת���ʵ� | |
| D�� | ��ʼ�����A��B���ʵ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
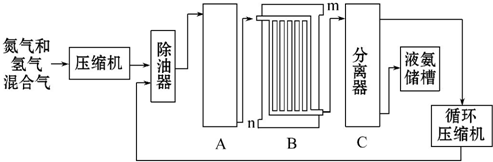
| �¶� �ε��ܽ�� | 0�� | 10�� | 20�� | 30�� | 40�� | 50�� | 60�� | 100�� |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 39.8 |
| NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | - | - | - | - |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 | - |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.3 | 77.3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
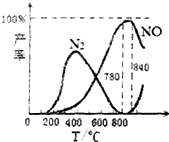
| A�� | N2��g��+O2��g��?2NO��g����H=+181.5kJ/mol | |
| B�� | NH3��ȼ����Ϊ226.25kJ/mol | |
| C�� | ��ҵ�ϰ�����������NOʱ���¶�Ӧ������780��840��֮�� | |
| D�� | �ò�˿�����������÷�Ӧ�����Ʊ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | C2H5OH��l��+3O2��g���T2CO2��g��+3H2O��g����H=-1 367.0 kJ•mol-1��ȼ���ȣ� | |
| B�� | KOH��aq��+HNO3��aq���TKNO3+H2O��l����H=+57.3 kJ•mol-1���к��ȣ� | |
| C�� | S��s��+O2��g���TSO2��g����H=-269.8 kJ•mol-1����Ӧ�ȣ� | |
| D�� | 2NO2�TO2+2NO��H=+116.2 kJ•mol-1����Ӧ�ȣ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 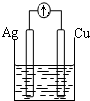 ϡ���� | B�� | 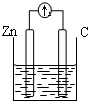 AgNO3��aq�� | C�� | 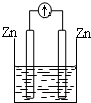 ���� | D�� | 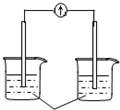 ϡ���� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com