
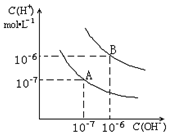
 已知水在25℃和95℃时,其电离平衡曲线如图所示:
已知水在25℃和95℃时,其电离平衡曲线如图所示:分析 曲线A条件下Kw=c(H+)×c(OH-)=10-7×10-7=10-14,曲线B条件下c(H+)=c(OH-)=10-6 mol/L,Kw=c(H+)•c(OH-)=10-12,水的电离时吸热过程,加热促进电离,所以A代表25℃时水的电离平衡曲线,B为95℃时水的电离曲线,
(1)根据稀释过程中氢氧化钠的物质的量不变计算出需要加入水的体积;
(2)酸、碱都是强电解质,溶液呈中性说明氢离子和氢氧根离子的物质的量相等,结合水的离子积常数确定强酸的pH1与强碱的pH2之间应满足的关系.
解答 解:曲线A条件下Kw=c(H+)×c(OH-)=10-7×10-7=10-14,曲线B条件下c(H+)=c(OH-)=10-6 mol/L,Kw=c(H+)•c(OH-)=10-12,水的电离时吸热过程,加热促进电离,所以A代表25℃时水的电离平衡曲线,B为95℃时水的电离曲线,
(1)25℃时pH=12NaOH溶液中氢氧根离子的浓度为0.01mol/L,pH=11的氢氧化钠溶液中氢氧根离子浓度为0.001mol/L,
稀释过程中氢氧根离子的物质的量基本不变,设需要加入水的体积为x,
则:$\frac{0.01mol/L×0.1L}{0.1L+x}$=0.001mol/L,解得:x=0.9L=900mL,
故答案为:900mL;
(2)要注意的是95°C时,水的离子积为10-12,即酸、碱浓度相等时pH(酸)+pH(碱)=12,现强碱的OH-浓度是强酸H+浓度的100倍,所以pH(酸)+pH(碱)=14,即a+b=14或pH1+pH2=14,
故答案为:a+b=14 或pH1+pH2=14.
点评 本题考查了溶液酸碱性与溶液pH的计算,题目难度中等,明确弱电解质的电离及其影响为解答关键,注意掌握溶液酸碱性与溶液pH的关系及计算方法,试题培养了学生的分析能力及化学计算能力.


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:选择题
| A. | Mg>Na>F>O | B. | O>F>Na>Mg | C. | Na>Mg>O>F | D. | O>F>Na>Mg |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
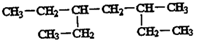 的下列说法中,不正确的是( )
的下列说法中,不正确的是( )| A. | 该有机物属于烷烃 | |
| B. | 该有机物与3-甲基-5-乙基辛烷互为同系物 | |
| C. | 该有机物与2,5-二甲基一3-乙基己烷互为同分异构体 | |
| D. | 该有机物命名时,主链上的碳原子数为6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
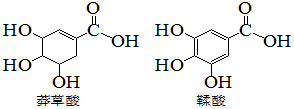
| A. | 莽草酸分子式为C7H10O5 | |
| B. | 两种酸都能与溴水发生加成反应 | |
| C. | 鞣酸分子与莽草酸分子互为同系物 | |
| D. | 等物质的量的两种酸与足量氢氧化钠反应,消耗氢氧化钠的物质的量相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在0.1mol•L-1的Na2A溶液中,c(A2-)+c(HA-)+2c(Na+)=0.5mol•L-1 | |
| B. | 在0.1mol•L-1的H2A溶液中,c(H+)>0.12mol•L-1 | |
| C. | 将同浓度(0.1mol•L-1)的NaHA和Na2A溶液等体积混合,混合溶液可能呈碱性 | |
| D. | 0.1mol•L-1的NaHA溶液中离子浓度为c(Na+)>c(H+)>c(A2-)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E、F、G七种元素位于元素周期表前四周期,原子序数依次增大.元素周期表中原子半径最小的是A,B原子最外层有两个未成对电子,化合物CD2为红棕色气体,E的单质易与水反应且只作氧化剂,元素F基态原子的3p轨道上有5个电子,G是第四周期元素,最外层只有一个电子,其余各层电子均充满.
A、B、C、D、E、F、G七种元素位于元素周期表前四周期,原子序数依次增大.元素周期表中原子半径最小的是A,B原子最外层有两个未成对电子,化合物CD2为红棕色气体,E的单质易与水反应且只作氧化剂,元素F基态原子的3p轨道上有5个电子,G是第四周期元素,最外层只有一个电子,其余各层电子均充满.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 离子化合物中可能含有共价键 | |
| B. | 阴、阳离子间通过静电作用所形成的化学键是离子键 | |
| C. | 溶于水可以导电的化合物一定是离子化合物 | |
| D. | 需要加热的化学反应一定是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
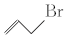 .则关于有机物
.则关于有机物  的说法正确的有( )
的说法正确的有( )| A. | 与苯互为同分异构体 | B. | 其二氯代物有3种 (不考虑立体异构) | ||
| C. | 分子中所有的碳原子在同一平面上 | D. | 属于烯烃,是乙烯的同系物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com