
| A. | 加水 | B. | 加少量冰醋酸 | C. | 降低温度 | D. | 加少量烧碱溶液 |
分析 要使溶液中$\frac{c(C{H}_{3}COOH)}{c({H}^{+})}$ 值减小,即醋酸的浓度减小,氢离子浓度增大,则平衡向电离的方向移动,结合影响平衡移动的因素解答该题.
解答 解:A.加水稀释,促进醋酸的电离,醋酸的物质的量减小,氢离子的物质的量增大,则$\frac{c(C{H}_{3}COOH)}{c({H}^{+})}$的值减小,故A正确;
B.加少量冰醋酸,醋酸浓度增大,弱电解质的浓度越大,电离程度越小,醋酸的物质的量增大,则$\frac{c(C{H}_{3}COOH)}{c({H}^{+})}$值增大,故B错误;
C.弱电解质的电离为吸热过程,降低温度醋酸的电离平衡向左移动,电离程度越小,则$\frac{c(C{H}_{3}COOH)}{c({H}^{+})}$值增大,故C错误;
D.加入烧碱固体,反应消耗氢离子生成CH3COO-,则c(CH3COO-)增大,由于Ka=$\frac{c(C{H}_{3}CO{O}^{-})×c({H}^{+})}{c(C{H}_{3}COOH)}$不变,则$\frac{c(C{H}_{3}COOH)}{c({H}^{+})}$增大,故D错误.
故选A.
点评 本题考查弱电解质的电离,侧重于考查学生的分析能力和化学基本概念的理解和应用能力,题目难度不大,注意把握影响弱电解质的电离的影响因素.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
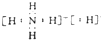 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④⑦ | B. | ①②⑤⑥ | C. | ③⑤⑥⑦ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
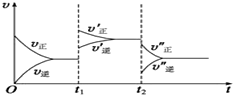 对于①N2(g)+3H2(g)??2NH3(g)△H<0 ②2NH3(g)?N2(g)+3H2(g)△H>0其中v-t图象为:
对于①N2(g)+3H2(g)??2NH3(g)△H<0 ②2NH3(g)?N2(g)+3H2(g)△H>0其中v-t图象为:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中和滴定盛待测液的锥形瓶中有少量水对滴定结果无影响,锥形瓶不能用待测液润洗 | |
| B. | 酸式和碱式滴定管用蒸馏水洗净后还需用标准液或待测液润洗 | |
| C. | 滴定时左手控制滴定管活塞,右手握持锥形瓶,边滴边振荡,眼睛注视滴定管的液面 | |
| D. | 称量氯化钠固体,氯化钠放在称量纸上,置于托盘天平的左盘,砝码放在天平的右盘 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入少量0.1 mol/L HCl溶液,溶液中c(H+)不变 | |
| B. | 加入少量CH3COONa固体,平衡向正反应方向移动 | |
| C. | 加入水时,平衡向逆反应方向移动 | |
| D. | 加入少量NaOH固体,平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t/s | 0 | 2 | 4 | 6 | 8 |
| n(Cl2)/mol | 0 | 0.030 | 0.039 | 0.040 | 0.040 |
| A. | 保持其他条件不变,升高温度,平衡时c(Cl2)=0.022mol•L-1,则反应的△H<0 | |
| B. | 反应在前2s的平均速率v(CO)=0.015mol•L-1•S-1 | |
| C. | 保持其他条件不变,起始向容器中充入0.12molCOCl2和0.060molCl2、0.060 molCO,反应达到平衡前的速率:v正<v逆 | |
| D. | 保持其他条件不变,起始向容器中充入0.10molCl2和0.08molCO,达到平衡时,Cl2的转化小于60% |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 弱酸的化学式 | CH3COOH | HCN | H2S |
| 电离常数(25℃) | 1.8×10-5 | 4.9×10-10 | K1=1.3×10-7 K2=7.1×10-15 |
| A. | 等物质的量浓度的各溶液PH关系为:PH(Na2S)>PH(NaCN)>PH(CH3COONa) | |
| B. | a mol/LHCN溶液与b mol/LNaOH溶液等体积混合,所得溶液中c(Na+)>c(CN-),则a一定大于b | |
| C. | NaHS和Na2S的混合溶液中,一定存在c(Na+)+c(H+)=c(OH-)+c(HS-)+c(S2-) | |
| D. | 某浓度的NaCN溶液的pH=d,则其中由水电离出的c(H+)=10-dmol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ③⑤④②① | C. | ①②③⑤④ | D. | ⑤③④①② |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com