
| 选项 | 物质 | 杂质 | 除杂试剂 | 除去杂质的方法 |
| A | NaCl溶液 | BaCl2 | Na2CO3溶液 | 过滤 |
| B | NaCl溶液 | I2 | CCl4 | 多次萃取、分液 |
| C | CCl4 | 汽油 | H2O | 分液 |
| D | CO2 | HCl | NaOH溶液 | 洗气 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.氯化钡可与碳酸钠反应生成沉淀,过滤可除去;
B.碘易溶于四氯化碳,分液可分离;
C.汽油不溶于水;
D.二者都与氢氧化钠溶液反应.
解答 解:A.氯化钡可与碳酸钠反应生成沉淀,过滤可除去,可用于除杂,注意碳酸钠应适量,如过量,应再加入盐酸,故A正确;
B.碘易溶于四氯化碳,四氯化碳不溶于水,分液可分离,故B正确;
C.汽油不溶于水,不能用水分离,故C错误;
D.二者都与氢氧化钠溶液反应,应用饱和碳酸氢钠溶液分离,故D错误.
故选AB.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、发生的反应及混合物分离方法选择为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识与实验相结合,题目难度不大.


科目:高中化学 来源: 题型:解答题
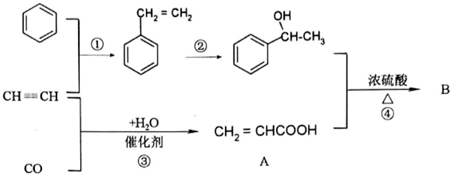
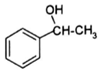 +CH2=CHCOOH$?_{△}^{浓H_{2}SO_{4}}$
+CH2=CHCOOH$?_{△}^{浓H_{2}SO_{4}}$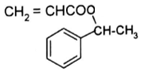 +H2O.
+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
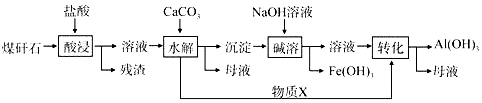
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在0.2L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如图所示,回答下列问题:
在0.2L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如图所示,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
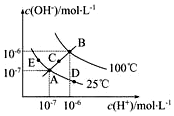 已知水的电离平衡曲线如图示,试回答下列问题:
已知水的电离平衡曲线如图示,试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ,B原子L层的电子总数是K层的3倍;0.1mol C单质能从酸中置换出2.24L氢气(标准状况),同时它的电子层结构变得与氖原子的电子层结构相同;D离子的半径比C离子的小,D离子与B离子的电子层结构相同.
,B原子L层的电子总数是K层的3倍;0.1mol C单质能从酸中置换出2.24L氢气(标准状况),同时它的电子层结构变得与氖原子的电子层结构相同;D离子的半径比C离子的小,D离子与B离子的电子层结构相同.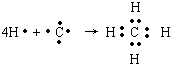 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化合反应 | B. | 复分解反应 | C. | 置换反应 | D. | 分解反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com