
| A.C60气化和I2升华克服的作用力相同 |
| B.分子晶体在水溶液中一定导电 |
| C.氯化钠和氯化氢溶于水时,破坏的化学键都是离子键 |
| D.用作高温结构陶瓷材料的Si3N4固体是分子晶体 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题
| A.通常状况下,60 g SiO2晶体中含有的分子数为NA(NA表示阿伏加德罗常数) |
| B.60 g SiO2晶体中,含有2NA个Si—O键 |
| C.晶体中与同一硅原子相连的4个氧原子处于同一四面体的4个顶点 |
| D.SiO2晶体中含有1个硅原子,2个氧原子 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
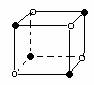
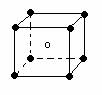
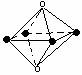
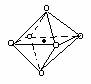
| A.图⑴和图⑶ | B.图⑵和图⑶ |
| C.只有图⑴ | D.图⑴和图⑷ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
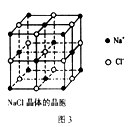
| A.7:8 | B.13:14 | C.25:26 | D.26:27 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
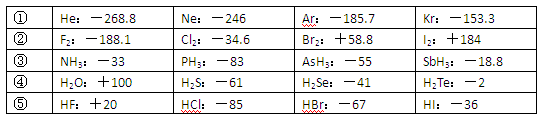
| A.同周期元素的氢化物,原子序数越大,沸点越高 |
| B.上表中H2O、HF中由于含有氢键,故其分子特别稳定 |
| C.上表中,多数物质的沸点均与相对分子质量存在一定的关系 |
| D.周期表中各主族元素的单质其沸点都随原子序数的增大而升高 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
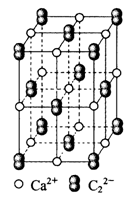
| A.1个Ca2+周围距离最近且等距离的C22-数目为6 |
| B.该晶体中的阴离子与F2是等电子体 |
| C.6.4克CaC2晶体中含阴离子0.1mol |
| D.与每个Ca2+距离相等且最近的Ca2+共有12个 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
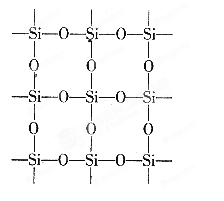
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
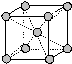


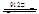 γ-Fe
γ-Fe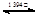 δ-Fe
δ-Fe查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
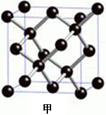

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com