
分析 将NO2、CO2的混合气体通过装有足量Na2O2的容器后,再用干燥烧瓶收集得到混合气体2.5mol,烧瓶中混合气体为二氧化氮和氧气,然后倒立于水槽中,最后水充满整个烧瓶,说明二氧化氮和氧气的物质的量之比为4:1,据此计算二氧化氮物质的量.
解答 解:将NO2、CO2的混合气体通过装有足量Na2O2的容器后,再用干燥烧瓶收集得到混合气体2.5mol,烧瓶中混合气体为二氧化氮和氧气,然后倒立于水槽中,最后水充满整个烧瓶,说明二氧化氮和氧气的物质的量之比为4:1,则二氧化氮物质的量=2.5mol×$\frac{4}{5}$=2mol,
故答案为:2mol.
点评 本题考查化学方程式的有关计算,为高频考点,侧重考查学生分析计算及理解题干信息能力,明确二氧化氮和氧气与水反应时二者关系是解本题关键,题目难度不大.


科目:高中化学 来源: 题型:实验题
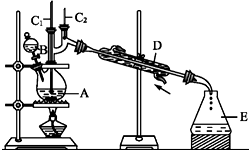
| 沸点/℃ | 密度/(g•cm-3) | 水中溶解性 | |
| 正丁醇 | 117.2 | 0.810 9 | 微溶 |
| 正丁醛 | 75.7 | 0.801 7 | 微溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
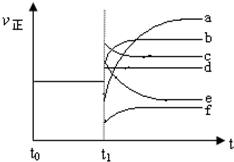 水煤气是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:
水煤气是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:| 容器编号 | c(H2O)/mol•L-1 | c(CO)/mol•L-1 | c(H2)/mol•L-1 | ν正、ν逆比较 |
| I | 0.06 | 0.60 | 0.10 | ν正=ν逆 |
| Ⅱ | 0.12 | 0.20 | 0.60① | ν正=ν逆 |
| Ⅲ | 0.10 | 0.20 | 0.40 | ν正_②>ν逆 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | B2H6(g)+3O2(g)═B2O3(s)+3H2O(g)△H=-2165kJ•mol-1 | |
| B. | B2H6(g)+3O2(g)═B2O3(s)+3H2O(g)△H=-2033kJ•mol-1 | |
| C. | B2H6(g)+3O2(g)═B2O3+3H2O△H=-2165kJ•mol-1 | |
| D. | B2H6(g)+O2(g)═B2O3(s)+H2O(l)△H=-2165kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeSO4(CuSO4):加足量铁粉后,过滤 | |
| B. | CO(CO2):用NaOH溶液洗气后干燥 | |
| C. | MnO2(KCl):加水溶解后,过滤、洗涤、烘干 | |
| D. | N2(O2):通过灼热的氧化铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl+Na2CO3、HCl+NaHCO3 | B. | BaCl2+Na2SO4、Ba(OH)2+NaHSO4 | ||
| C. | KOH+HCl、Ba(OH)2+H2SO4 | D. | 石灰石与硝酸、石灰石与盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 已知乙醇可以和氯化钙反应生成微溶于水的CaCl2•6C2H5OH.
已知乙醇可以和氯化钙反应生成微溶于水的CaCl2•6C2H5OH.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com