
| 难溶电解质 | AgCl | AgBr | AgI | Ag2SO4 | Ag2CrO4 |
| Ksp | 1.8×10-10 | 5.4×10-13 | 8.5×10-17 | 1.4×10-5 | 1.12×10-12 |
| A. | 由溶度积常数不能判断相应物质的溶解性大小 | |
| B. | 将等体积的4×10-3 mol/L的AgNO3溶液和4×10-3mol/L K2CrO4溶液混合,有Ag2CrO4沉淀产生 | |
| C. | 向AgCl的悬浊液中滴加饱和NaBr溶液不能得到黄色AgBr | |
| D. | 向100 mL 0.02mol/L的NaSO4溶液中加入100mL0.02mol/L的AgNO3溶液,有白色沉淀生成 |
分析 A.如物质的结构相似,可根据溶度积大小比较溶解性;
B.Ag2CrO4的溶度积为1.12×10-12,计算判断能否生成沉淀;
C.溶度积常数表示饱和溶解后各种离子的浓度的乘积,Ksp越小表示电解质越稳定,AgBr的溶度积比AgCl小,前者更容易形成更稳定的沉淀;
D.硫酸银是常见的难电离物质,根据Ksp计算判断.
解答 解:A.如物质的结构相似,可根据溶度积大小比较溶解性,表中物质的组成结构不同,不能用溶度积比较溶解性,故A正确;
B.由离子的浓度可知,(2×10-3)2×(2×10-3)=8×10-9>1.12×10-12,所以有Ag2CrO4沉淀产生,故B正确;
C.由表格中的Ksp可知,1.8×10-10>5.4×10-13,则AgBr的溶度积比AgCl小,所以向AgCl的悬浊液中滴加NaBr的饱和溶液可以得到黄色AgBr悬浊液,故C错误;
D.由离子浓度可知,0.01×(0.01)2=10-6<1.4×10-5,则没有白色沉淀生成,故D错误;
故选CD.
点评 本题考查学生利用溶度积进行计算,为高频考点,侧重考查学生的分析、计算能力的考查,明确沉淀的转化、离子浓度、溶度积与生成沉淀的关系即可解答,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:推断题
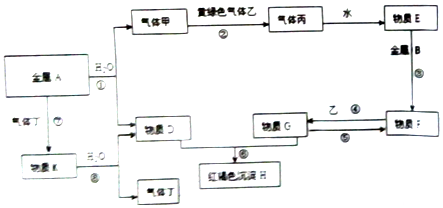
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容量瓶和滴定管都需要用试剂润洗 | |
| B. | 用NaOH滴定盐酸时,若滴定结束时俯视刻度,会导致测定结果偏高 | |
| C. | 用滴定管准确量取20.0 mL盐酸 | |
| D. | 用KMnO4滴定亚硫酸钠溶液的实验中不需要另外加入指示剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | Ca3(PO4)2 | CaHPO4 | Ca(H2PO4)2 |
| 溶解度(g•L-1) | 2×10-2 | 4.303×10-2 | 18 |
| A. | 含Ca(H2PO4)2的磷肥可以与草木灰混施 | |
| B. | Ksp[CaHPO4]=c(Ca2+)•c(H+)•c(PO43-) | |
| C. | 20℃时,Ca(H2PO4)2饱和溶液物质的量浓度为0.13 mol•L-1 | |
| D. | 向澄清石灰水中逐滴滴入稀磷酸,开始出现浑浊,后变澄清 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度 | 平衡时NH3的 物质的量mol |
| T1 | 1.2 |
| T2 | 1.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
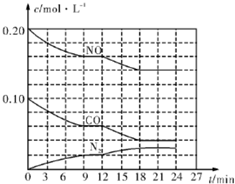 为有效控制雾霾,各地积极采取措施改善大气质量.有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要.在汽车排气管内安装催化转化器,可将汽车尾气中主要污染物转化为无毒的大气循环物质.热化学反应方程式为 2N0(g)+2C0(g)?N2 (g)+2C02 (g)△H=-746.5kJ•mol-1,将1.0mol N0和1.0mol C0充入一个容积为10L的密闭容器中,反应过程中物质浓度变化如图所示.
为有效控制雾霾,各地积极采取措施改善大气质量.有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要.在汽车排气管内安装催化转化器,可将汽车尾气中主要污染物转化为无毒的大气循环物质.热化学反应方程式为 2N0(g)+2C0(g)?N2 (g)+2C02 (g)△H=-746.5kJ•mol-1,将1.0mol N0和1.0mol C0充入一个容积为10L的密闭容器中,反应过程中物质浓度变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com