
【题目】FeCl3是一种常用的净水剂,某化学小组同学用如下装置制备无水FeCl3。已知无水FeCl3在空气中易潮解,加热易升华。请回答下列问题:
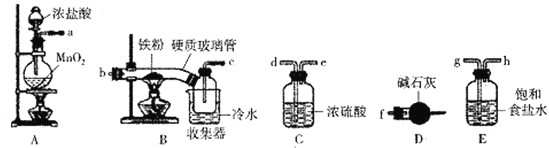
(1)装置A中发生的离子反应方程式为_______________________________。
(2)装置接口的连接顺序为____________ (用a、b、c……h表示)。
(3)装置B中收集器放在冷水中的作用为______________________。
(4)反应结束后,该小组同学对装置B中硬质玻璃管的右端进行加热,其目的是_________________。
(5)反应结束后,该小组同学将装置B中的残留物投入到足量盐酸中溶解.对所得溶液进行如下实验研究,请完成下表实验设计(药品自选)。
实验步骤 | 实验现象 | 实验结论 |
①取少许上述溶液,加入KSCN溶液 | ______ | 含有Fe3+ |
②取少许上述溶液,加入______ | 紫色溶液逐渐变浅至褪色 | _____ |
(6)工业上可用5.0mol·L-1的FeCl3溶液吸收H2S气体,若要吸收170gH2S气体;则需要该FeCl3溶液的体积为____________ mL。
【答案】 MnO2+4H++2Cl-![]() Mn2+Cl2↑+2H2O aghdebcf 冷却使FeCl3沉积,便于收集 使沉积在B中硬质玻璃管的有端的FeCl3进入收集器 溶液出现血红色 酸性KMnO4溶液 含有Fe2+ 2000
Mn2+Cl2↑+2H2O aghdebcf 冷却使FeCl3沉积,便于收集 使沉积在B中硬质玻璃管的有端的FeCl3进入收集器 溶液出现血红色 酸性KMnO4溶液 含有Fe2+ 2000
【解析】(1)A装置制取氯气,装置A中发生的离子反应方程式为:MnO2+4H++2Cl-![]() Mn2+Cl2↑+2H2O;(2)A装置制取氯气,制得的氯气中混有氯化氢和水蒸气,用饱和食盐水吸收氯化氢气体,所以a连接g连接h,在C装置中用浓硫酸吸收水蒸气,为吸收充分,导气管长进短出,则h连接d连接e,干燥纯净的氯气在B中与铁反应,则e连接b连接c,氯气不能直接排放,用硫代硫酸钠在D装置中尾气吸收,为防止D装置中的水蒸气进入氯化铁的收集装置,故尾气处理之前再接一个干燥装置;故答案为:a,g,h,d,e,b,c,f; (3)装置B中收集器放在冷水中的作用为:冷却使FeCl3沉积,便于收集;(4)反应结束后,该小组同学对装置B中硬质玻璃管的右端进行加热,三氯化铁升华,其目的是:使沉积在B中硬质玻璃管的有端的FeCl3进入收集器;(5)①取少许上述溶液,溶液中有铁离子,加入KSCN溶液,溶液出现血红色,检验溶液中的铁离子;②取少许上述溶液,含有亚铁离子,加入酸性KMnO4溶液,紫红色褪去,说明溶液中含有亚铁离子;(6)工业上可用5.0mol·L-1的FeCl3溶液吸收H2S气体,若要吸收170gH2S气体;则需要该FeCl3溶液的体积为
Mn2+Cl2↑+2H2O;(2)A装置制取氯气,制得的氯气中混有氯化氢和水蒸气,用饱和食盐水吸收氯化氢气体,所以a连接g连接h,在C装置中用浓硫酸吸收水蒸气,为吸收充分,导气管长进短出,则h连接d连接e,干燥纯净的氯气在B中与铁反应,则e连接b连接c,氯气不能直接排放,用硫代硫酸钠在D装置中尾气吸收,为防止D装置中的水蒸气进入氯化铁的收集装置,故尾气处理之前再接一个干燥装置;故答案为:a,g,h,d,e,b,c,f; (3)装置B中收集器放在冷水中的作用为:冷却使FeCl3沉积,便于收集;(4)反应结束后,该小组同学对装置B中硬质玻璃管的右端进行加热,三氯化铁升华,其目的是:使沉积在B中硬质玻璃管的有端的FeCl3进入收集器;(5)①取少许上述溶液,溶液中有铁离子,加入KSCN溶液,溶液出现血红色,检验溶液中的铁离子;②取少许上述溶液,含有亚铁离子,加入酸性KMnO4溶液,紫红色褪去,说明溶液中含有亚铁离子;(6)工业上可用5.0mol·L-1的FeCl3溶液吸收H2S气体,若要吸收170gH2S气体;则需要该FeCl3溶液的体积为
2FeCl3 + H2S=2FeCl2+2HCl+S↓
2mol 34g
V×5.0mol·L-1 170g
![]()
V=2L=2000mL


科目:高中化学 来源: 题型:
【题目】检验SO2气体中是否混有CO2气体,可采用的方法是( )
A.通过HNO3酸化的Ba(NO3)2溶液
B.先通过足量品红溶液,再通过澄清石灰水
C.先通过足量NaOH溶液,再通过澄清石灰水
D.先通过足量酸性KMnO4溶液,再通过澄清石灰水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烟气(主要污染物SO2、NOx)经O3预处理后用CaSO3水悬浮液吸收,可减少烟气中SO2、NOx的含量。O3氧化烟气中SO2、NOx的主要反应的热化学方程式为:NO(g)+O3(g)=NO2(g)+O2(g) △H=-200.9kJ·mol-1 NO(g)+1/2O2(g)=NO2(g) △H=-58.2kJ·mol-1 SO2(g)+O3(g)=SO3(g)+O2(g) △H=-241.6kJ·mol-1
(1)反应3NO(g)+O3(g)=3NO2(g)的△H=_______mol·L-1。
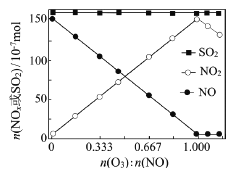
(2)室温下,固定进入反应器的NO、SO2的物质的量,改变加入O3的物质的量,反应一段时间后体系中n(NO)、n(NO2)和n(SO2)随反应前n(O3):n(NO)的变化见右图。
①当n(O3):n(NO)>1时,反应后NO2的物质的量减少,其原因是_________________
②增加n(O3),O3氧化SO2的反应几乎不受影响,其可能原因是___________________。
(3)当用CaSO3水悬浮液吸收经O3预处理的烟气时,溶液(pH约为 8)中SO32-将NO2转化为NO2-,其离子方程式为:_________________________________________________________________________________
(4)CaSO3水悬浮液中加入Na2SO4溶液,达到平衡后溶液中c(SO32-)=_____________________________[用c(SO42-)、Ksp(CaSO3)和Ksp(CaSO4)表示];CaSO3水悬浮液中加入Na2SO4溶液能提高NO2的吸收速率,其主要原因是__________________________________________________________________
(5)甲醇燃料电池在碱性溶液中的电极反应式。正极_________________________________;负极____________________________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着生活水平的提高,人们越来越重视“绿色食品”,绿色食品是指( )
A.添加了绿色色素的食品
B.含有叶绿素的食品
C.原料生产过程中没有使用化肥、农药的食品
D.原料生产及加工过程中没有受到污染的食品
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生欲用已知物质的量浓度为0.1000mol/L的NaOH溶液来测定未知物质的量浓度的盐酸,选择酚酞作指示剂.请填写下列空白:![]()
(1)如图仪器的名称是 .
(2)用标准的氢氧化钠溶液滴定待测的盐酸时,左手挤压橡皮管中玻璃小球,右手摇动锥形瓶,眼睛注视 , 滴定终点的判断方法是 .
(3)根据下面表格数据,可计算出该盐酸的浓度约为(保留两位有效数字).
实验 | NaOH溶液的 | 滴定完成时,溶液滴入的体积/mL aOH | 待测盐的体积/mL酸 |
1 | 0.10 | 22.62 | 20.00 |
2 | 0.10 | 22.72 | 20.00 |
3 | 0.10 | 22.80 | 20.00 |
(4)在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有 .
A.滴定终点读数时俯视读数
B.酸式滴定管使用前,水洗后未用待测盐酸、润洗
C.锥形瓶水洗后未干燥
D.碱式滴定管尖嘴部分有气泡,滴定后消失.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据新浪网报道,欧洲一集团公司拟在太空建立巨大的集光装置,把太阳光变成激光用于分解海水制氢,其反应可表示为:2H2O ![]() 2H2↑+O2↑.有下列几种说法:①水分解反应是放热反应;②若用生成的氢气与空气中多余的二氧化碳反应生成甲醇储存起来,可改善生存条件;③使用氢气作燃料有助于控制温室效应;④氢气是一级能源.其中叙述正确的是( )
2H2↑+O2↑.有下列几种说法:①水分解反应是放热反应;②若用生成的氢气与空气中多余的二氧化碳反应生成甲醇储存起来,可改善生存条件;③使用氢气作燃料有助于控制温室效应;④氢气是一级能源.其中叙述正确的是( )
A.①②
B.③④
C.②③
D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H、C、N、O、F、Se是六种重要的非金属元素。请根据所学的物质结构与性质的相关知识回答下列问题:
(1)基态氮原子最高能级上电子的自旋方向有________种,基态硒原子的价层电子排布式为________,N元素第一电离能大于O元素第一电离能的原因为____________。
(2)某高效低毒的新型农药的结构简式为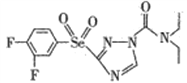 ,则该物质中氮原子的杂化轨道类型为________,其分子之间________(填“能”或“不能”)形成氢键。
,则该物质中氮原子的杂化轨道类型为________,其分子之间________(填“能”或“不能”)形成氢键。
(3)SeO2、SeO2两种分子中,属于非极性分子的是________,SeO2的空间构型为________,与SeO3互为等电子体的分子和离子为________。(各写一种)
(4)氮化硼(BN)晶体有多种结构,六方相氮化硼(晶体结构如图1)是通常存在的稳定相,可作高温润滑剂,立方相氮化硼(晶体结构如图2)是超硬材料,有优异的耐磨性。
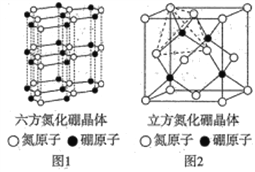
①下列关于这两种晶体的说法正确的是________ (填字母)。
a.两种晶体存在的作用力相同 b.立方氮化硼晶体可用于生产金属切割刀片
c.六方相氮化硼层间作用力小,所以质地软 d.立方相氮化硼含有σ键和π键,所以硬度大
②若图2中晶胞的边长为anm,密度为ρg·cm-3,则阿伏加德罗常数的值为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置进行下列实验,将分液漏斗中溶液X加入圆底烧瓶中与Y反应,对试管B中现象描述不正确的是
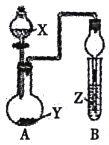
选项 | X溶液 | 固体Y | Z溶液 | 现象 |
A | 70%H2SO4 | Na2SO3溶液 | H2S溶液 | 产生浑浊 |
B | 浓氨水 | CaO | 酚酞试剂 | 溶液变红 |
C | 盐酸 | 大理石 | Na2SiO3溶液 | 出现白色沉淀 |
D | 浓盐酸 | MnO2 | NaOH溶液 | 黄绿色气体被吸收 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某气态烃在标准状况下的体积为2.8 L,其质量为2 g,该烃中氢元素的质量分数为25%,则该烃的分子式为________,电子式为____________,结构式为____________,其立体构型为________。
(2)如图立方体中心的“●”表示甲烷分子中的碳原子,请在立方体的顶点用“●”表示出与之紧邻的4个氢原子的位置。______________

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com